Сероводород h3S – Что такое Сероводород h3S?
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
Общая характеристика
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S – самое активное из серосодержащих соединений.
В нормальных условиях – бесцветный газ с неприятным запахом тухлых яиц.
Газ – потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле – 5 9 – 6 0; в керосине – 2 4 – 2 5; в легкой нефти – 1,5 – 1,75.
Взрывоопасен в смеси с воздухом в диапазоне 4 – 45% об.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки
Области применения
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Влияние сероводорода на организм человека
Сероводород – токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Ощутимый запах – при концентрации H2S 1,4 – 2,3 мг/м3, значительный запах – 4 мг/м3, тяжелый запах – от 7 мг/м3.
Острое отравление наступает уже при концентрациях 0,2 – 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) – смертельна для человека.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне – 10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами – 3 мг/м3.
ПДК H2S в воздухе населенных мест- 0,008 мг/м3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
Получение H
2S– реакция взаимодействия разбавленных кислот с сульфидами
– реакция взаимодействия сульфида алюминия с водой
– сплавление парафина с серой.
Сероводород в окружающей среде
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
К примеру, в Черном море слои воды, расположенные глубже 150 -200 м содержат растворенный H2S.
Содержится в сырой нефти.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Кишечные газы человека и животных тоже содержат H2S. Чуть – чуть, но малоприятно.
Сероводород. Что это такое? Формула, соединения и примеры
Поможем понять и полюбить химию
Начать учитьсяЧтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2
Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.

Химические свойства сероводорода
Горение
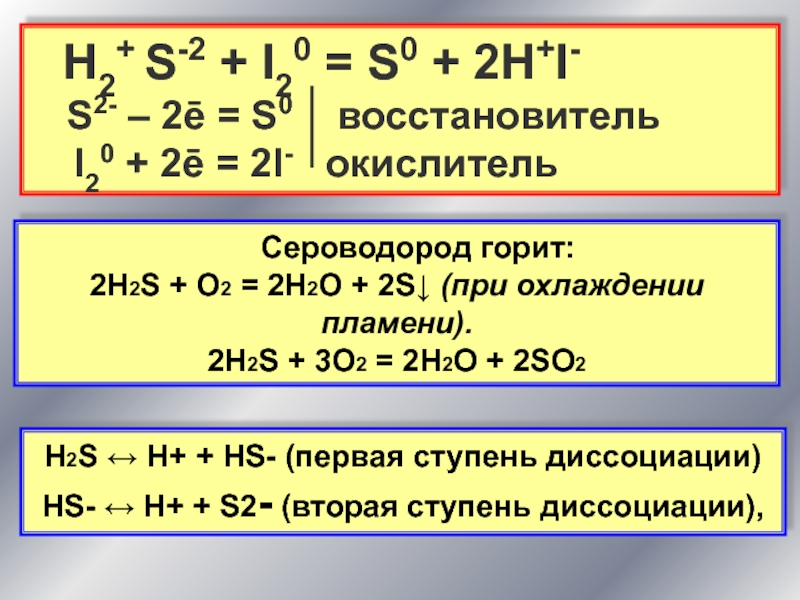
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H 2O.
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
H2S ⇄ H+ + HS−.
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2
S + 2H2O;сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.

Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
в реакции с бромной водой наблюдается обесцвечивание раствора:
H 2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO
H2S + H2SO4 (конц) → S + SO2 + 2H2O.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S−2 → S+4 соответствует уравнение:
2H2S + O2 → S + 2H2O
H2SO3 + H2O2 → H2SO4 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
2H2S + 3O2 → 2SO2 + 2H2O
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.

Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
Верно только А
Верно только Б
Оба верны
Оба неверны
Татьяна Сосновцева
К предыдущей статье
268.5KВалентность
К следующей статье
Химия углерода
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Сероводород – Обзор | Управление по безопасности и гигиене труда
- Вопросы безопасности и гигиены труда
- Сероводород
Сероводород
Обзор
Основные моменты
Сероводород является одной из основных причин смерти от вдыхания газов на рабочем месте в Соединенных Штатах. По данным Бюро статистики труда (BLS), в период с 2011 по 2017 год сероводород стал причиной смерти 46 рабочих9.0015
По данным Бюро статистики труда (BLS), в период с 2011 по 2017 год сероводород стал причиной смерти 46 рабочих9.0015
Почему сероводород так опасен?
- Он легко воспламеняется и токсичен даже при низких концентрациях.
- Он тяжелее воздуха и может перемещаться по земле.
- Может накапливаться в низинах и замкнутых пространствах (включая закрытые, плохо проветриваемые помещения, такие как навозные ямы, канализация, люки и подземные хранилища).
- Через какое-то время при низких или быстрее при высоких концентрациях вы больше не можете чувствовать запах, чтобы предупредить вас, что он там.
- Может быстро, практически сразу одолеть неподготовленных рабочих, в том числе и спасателей.
Сероводород (также известный как H 2 S, канализационный газ, болотный газ, вонючая влага и кислая влага) представляет собой бесцветный газ, известный своим резким запахом «тухлых яиц» при низких концентрациях. Он чрезвычайно легко воспламеняется и очень токсичен.
Он чрезвычайно легко воспламеняется и очень токсичен.
Сероводород используется или производится в ряде отраслей промышленности, таких как
- Переработка нефти и газа
- Горное дело
- Дубление
- Целлюлозно-бумажная промышленность
- Вискоза производство
Сероводород также встречается в природе в канализации, навозных ямах, колодезной воде, нефтяных и газовых скважинах и вулканах. Поскольку сероводород тяжелее воздуха, он может скапливаться в низменных и замкнутых пространствах, таких как люки, канализация и подземные телефонные хранилища. Его присутствие делает работу в замкнутом пространстве потенциально очень опасной.
Воздействие сероводорода на здоровье зависит от того, насколько H 2 S рабочий дышит и как долго. Однако многие эффекты наблюдаются даже при низких концентрациях. Эффекты варьируются от легких, головных болей или раздражения глаз, до очень серьезных, потери сознания и смерти.
На этой веб-странице представлена информация о том, как сероводород может повлиять на ваше здоровье, где его можно найти и как предотвратить вредное воздействие.
Стандарты
Воздействие сероводорода рассматривается в конкретных стандартах OSHA для общей промышленности, морского судоходства и строительства.
Подробнее »
Опасности
Предоставляет информацию о влиянии сероводорода на безопасность и здоровье.
Подробнее »
Сероводород на рабочих местах
Обсудите, где можно найти сероводород.
Подробнее »
Оценка/Контроль воздействия
Предоставляет информацию об оценке наличия газообразного сероводорода и о том, как устранить или контролировать источник, когда это возможно.
Подробнее »
Дополнительные ресурсы
Содержит ссылки и ссылки на дополнительные ресурсы, связанные с сероводородом.
Подробнее »
Основные моменты
Сероводород является одной из основных причин смерти от вдыхания газов на рабочем месте в Соединенных Штатах. По данным Бюро статистики труда (BLS), в период с 2011 по 2017 год сероводород стал причиной смерти 46 рабочих.
Почему сероводород так опасен?
- Он легко воспламеняется и токсичен даже при низких концентрациях.
- Он тяжелее воздуха и может перемещаться по земле.
- Может накапливаться в низинах и замкнутых пространствах (включая закрытые, плохо проветриваемые помещения, такие как навозные ямы, канализация, люки и подземные хранилища).
- Через какое-то время при низких или быстрее при высоких концентрациях вы больше не можете чувствовать запах, чтобы предупредить вас, что он там.
- Может быстро, практически сразу одолеть неподготовленных рабочих, в том числе и спасателей.
Опасность газа h3S
Что такое газ h3S?
Газ h3S представляет собой химическое соединение, обозначающее сероводород, карбонилсульфидный газ. Это бесцветный газ, который обычно известен своим отчетливым запахом тухлых яиц. Газ h3S также часто называют канализационным газом, кислым газом, вонючей влагой или сероводородной кислотой. Газ h3S чрезвычайно ядовит для человека, вызывает коррозию и легко воспламеняется. При горении газ h3S выделяет другой смертоносный газ: диоксид серы, симптомы и последствия которого схожи с воздействием газа h3S. К сожалению, год за годом рабочие случайно подвергаются воздействию газа h3S, многие из которых страдают от пагубных последствий, поскольку небезопасное количество может убить рабочего менее чем за 10 секунд.
Газ h3S чрезвычайно ядовит для человека, вызывает коррозию и легко воспламеняется. При горении газ h3S выделяет другой смертоносный газ: диоксид серы, симптомы и последствия которого схожи с воздействием газа h3S. К сожалению, год за годом рабочие случайно подвергаются воздействию газа h3S, многие из которых страдают от пагубных последствий, поскольку небезопасное количество может убить рабочего менее чем за 10 секунд.
Где это можно найти?
Газ h3S растворим в воде и масле. Он может высвобождаться в любое время, когда вещество нагревается или сбрасывается давление. Он содержится в сырой нефти, природном газе, некоторых минеральных породах и горячих источниках. Поэтому бурение и добыча сырой нефти и природного газа создают выбросы сероводорода. Он также может присутствовать, когда бактерии в органических материалах или отходах человека/животных разлагаются в отсутствие кислорода. К отраслям промышленности, производящим наибольшее количество газа H3S, относятся очистка сточных вод, кожевенные заводы, бумажные фабрики, производство клея и красителей, горнодобывающая промышленность, строительство, бурение и переработка природного газа.
Сам по себе газ тяжелее воздуха и поэтому имеет тенденцию скапливаться в замкнутых, низких пространствах. Области с плохой вентиляцией, такие как канализационные трубы, навозные ямы или подвалы, скорее всего, являются местами, где может собираться и задерживаться газ H3S. Другие условия, в которых газообразный сероводород может представлять опасность, включают расщепление древесины на целлюлозу, работу на болотах или свалках, а также при добыче полезных ископаемых, где присутствуют горные породы.
Симптомы и предупреждающие сигналы для газа h3S
Газ h3S может быть смертельным даже в самых малых количествах, а значительные концентрации газа часто убивают обоняние жертвы. Следовательно, отчетливый «запах яиц» не следует использовать в качестве меры того, сколько присутствует газообразного сероводорода. Рабочий может оказаться в фатальной ситуации за считанные секунды. Если присутствует низкий уровень газа h3S, могут возникнуть болезненность глаз, проблемы с дыханием, кашель, насморк, головная боль, спутанность сознания, тошнота или дезориентация. Газ h3S настолько смертоносен из-за небольшого количества, которое способно убить рабочего. Таким образом, не следует легкомысленно относиться к любым симптомам, которые могут быть вызваны даже самым низким уровнем газообразного сероводорода.
Газ h3S настолько смертоносен из-за небольшого количества, которое способно убить рабочего. Таким образом, не следует легкомысленно относиться к любым симптомам, которые могут быть вызваны даже самым низким уровнем газообразного сероводорода.
Какие опасности и риски связаны с воздействием газа h3S?
Газ h3S считается раздражающим и удушающим химическим веществом. Это любое вещество, которое препятствует поступлению кислорода из нашего кровотока в наши клетки или препятствует клеточному дыханию, даже если в непосредственной близости имеется достаточное количество кислорода. Другими словами, газ h3S может эффективно мешать рабочему дышать, когда легкие поглощают газ. В зависимости от присутствующего уровня работник обычно замечает раздражение глаз, насморк и кашель. Если уровни увеличиваются, последствия становятся все более серьезными, и начинают проявляться побочные эффекты, упомянутые ранее, такие как головокружение и тошнота до смерти в течение нескольких секунд.
Число смертельных случаев и статистика от газа h3S По данным Управления по охране труда и технике безопасности, h3S является одной из основных причин смерти от вдыхания газа на рабочем месте в Соединенных Штатах. По данным Бюро статистики труда, сероводород стал причиной смерти 60 рабочих в период с 2001 по 2010 год. Концентрации выше 1000 частей на миллион вызывают немедленный коллапс с остановкой дыхания, даже после вдыхания одного вдоха — смерть может наступить в течение одного-четырех часов после воздействия.
По данным Бюро статистики труда, сероводород стал причиной смерти 60 рабочих в период с 2001 по 2010 год. Концентрации выше 1000 частей на миллион вызывают немедленный коллапс с остановкой дыхания, даже после вдыхания одного вдоха — смерть может наступить в течение одного-четырех часов после воздействия.
Одинокие рабочие и газ h3S
Кто подвергается риску воздействия газа h3S?
Одинокие работники, которые с наибольшей вероятностью могут подвергаться воздействию опасного уровня газа h3S, включают в себя тех сотрудников, которым приходится работать в небольших или замкнутых помещениях с плохой вентиляцией, например, в нефтяной и газовой промышленности. Но кроме того, строитель, входящий, например, в дренажную канаву, может сразу же столкнуться с h3S и не иметь возможности вовремя среагировать. Работники, работающие с любыми источниками воспламенения, также подвергаются риску из-за легковоспламеняющейся природы h3S. Кроме того, газ чрезвычайно взрывоопасен и может взорваться рядом с сигаретами, трубками или даже спичками. Окружающая среда, в которой есть «неподвижный воздух», также опасна. В любом месте, где не допускается свободный поток свежего воздуха, может образоваться скопление газа, которое может очень быстро увеличиться до уровня токсичности. Наконец, наибольшему риску подвергаются сотрудники, которые не осведомлены о предупреждающих признаках присутствия газа H3S. Это может включать любых работников во всех отраслях промышленности. Протоколы должны в первую очередь информировать работников о важности респираторного устройства при осмотре места утечки h3S или спасении коллеги. Знание предупреждающих сигналов, симптомов, побочных эффектов и протоколов может спасти вашу жизнь и жизнь ваших коллег.
Окружающая среда, в которой есть «неподвижный воздух», также опасна. В любом месте, где не допускается свободный поток свежего воздуха, может образоваться скопление газа, которое может очень быстро увеличиться до уровня токсичности. Наконец, наибольшему риску подвергаются сотрудники, которые не осведомлены о предупреждающих признаках присутствия газа H3S. Это может включать любых работников во всех отраслях промышленности. Протоколы должны в первую очередь информировать работников о важности респираторного устройства при осмотре места утечки h3S или спасении коллеги. Знание предупреждающих сигналов, симптомов, побочных эффектов и протоколов может спасти вашу жизнь и жизнь ваших коллег.
Каковы долгосрочные последствия воздействия сероводорода на здоровье рабочего?
Продолжительное вдыхание газа h3S может привести к серьезному поражению центральной нервной системы человека, при высокой концентрации человек может потерять сознание, кому, судороги и даже умереть. Кратковременное воздействие газа h3S может вызвать головную боль, тошноту и раздражение глаз и кожи.
Кратковременное воздействие газа h3S может вызвать головную боль, тошноту и раздражение глаз и кожи.
К воздействию h3S нельзя относиться легкомысленно. Всего через пять минут рабочий рискует пошатнуться и упасть. Через 30 минут у них серьезно пострадают глаза. Всего через 30–60 минут они могли умереть. Согласно исследованию Annals of Saudi Medicine, «h3S приводит к немедленному летальному исходу, когда концентрация превышает 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызвать различные респираторные симптомы, которые варьируются от ринита до острая дыхательная недостаточность. h3S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах».
Что можно сделать для снижения опасности, связанной с газом h3S?Итак, что можно сделать, чтобы защитить ваших одиноких работников от этой невидимой угрозы? Вы можете предпринять ряд упреждающих действий, например:
Предоставить средства защиты органов дыхания и средства индивидуальной защиты (СИЗ).

Предоставить автоматизированную систему регистрации, например, приложение для обеспечения безопасности одинокого работника
Вся электроника должна быть помещена в искробезопасный корпус
Установка взрывозащищенных и коррозионностойких систем приточно-вытяжной вентиляции.
Обучите свою команду опасностям и средствам контроля, включая симптомы воздействия h3S и протоколы, которым необходимо следовать в случае воздействия.
Разработать и отработать аварийно-спасательные процедуры.
Оборудование для обнаружения опасного газа
Оборудование для обнаружения h3S включает в себя устройства, которые обнаруживают и предупреждают работника о небезопасном качестве воздуха посредством звуковой и вибрационной сигнализации.
Многие доступные устройства обнаруживают несколько газов и могут обнаруживать ряд вредных газов и паров во время выполнения работы. Они варьируются в цене от сотен до тысяч долларов, в зависимости от потребностей безопасности вашего рабочего места.