Буферные емкости. Что это такое и зачем они нужны ≋ Т-ДІМ Луцк
Буферные емкости. Что это такое и зачем они нужны?
Все мы знаем о том, для чего нужны водонагреватели. Но когда речь заходит о буферные емкости, большинство людей не понимает для чего они нужны. Итак, что представляет собой буферная емкость и для чего она необходима.
Накопительные емкости (буферные емкости, накопительные баки, гидроаккумуляторы) – это элементы системы отопления, предназначенные для аккумуляции избыточного тепла, которое выделяется от твердотопливного котла, балансируя его работу.
Большинство пользователей предпочитают, чтобы их котел горел как можно дольше и бесперебойно работал в течение долгих лет. В этом ему могут помочь накопительные емкости с правильным подбором дополнительного оборудования.
Если у вас установлен твердотопливный котел, Вам, наверное, знакома ситуация: зимой котел выключен, в доме холодно. Котел разгорается, разгорается – в доме жара. Котел прогорает и охлаждается – опять холодно.
Котел прогорает и охлаждается – опять холодно.
В большинстве видов твердого топлива существует три фазы горения – разгорания, интенсивного горения и затухания. В процессе интенсивного горения топливо отдает тепла больше, чем это нужно системе, а вот начальная и конечная фазы, наоборот, дают недостаточно тепла. При использовании такого топлива в доме часто бывают большие перепады температур, поэтому комфортная температура не стабильна.
Буферная емкость призвана сглаживать эти неровности. В фазе интенсивного горения емкость берет на себя излишки тепла, а после затухания котла продолжает отдавать тепло в систему отопления. Это позволяет не только поддерживать нужную температуру в помещении, но и экономить топливо!
Буферные баки – это реальная экономия ваших средств и комфорт температурного режима.
Современные системы отопления имеют гораздо меньший объем воды. Поэтому при установлении твердотопливного котла необходимо буферная емкость, которая позволяет поглощать лишнюю тепловую енергию при достигнутой комфортной температуре в помещении.
С помощью буферной емкости Вы сможете:
- обеспечить стабильную температуру в доме;
- уникнуты перегрева и твердотопливного котла;
- организовать безопасную работу отопительной системы;
- заощадиты энергоресурсы.
Когда нужно купить буферную емкость?
- Когда используете тепловой насос.
- Когда установлено котел на твердом топливе.

- Есть перепады температур в системе отопления.
- Хотите сэкономить средства.
Бывают буферные емкости:
- без теплообменника;
- с одним теплообменником;
- с несколькими теплообменниками.
Как правильно выбрать объем буферной емкости?
Необходимо провести следующий расчет:
1 кВт мощности котла = от 30 до 50 литров объема теплоносителя (зависит от калорийности топлива применяемого)
Купить буферную емкость Вы всегда сможете в магазине “ТЕПЛЫЙ ДОМ ПСП” в г.Луцк г-н Привокзальный, 1 или на нашем сайте https://t-dim.com.ua
тел .: +38 (067) 447-05-49, 050-433-77-18
Буферная емкость
Способность
буферных систем противодействовать
резкому изменению рН при добавлении к
ним сильной кислоты или основания
является ограниченной. Буферная смесь
поддерживает рН постоянным только при
условии, что количество вносимых в
раствор сильной кислоты или щелочи не
превышает определенной величины. В
противном случае наблюдается резкое
изменение рН, т.е. буферное действие
раствора прекращается.
В
противном случае наблюдается резкое
изменение рН, т.е. буферное действие
раствора прекращается.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкость по основанию или щелочи (Во.).
Буферной
емкостью по кислотеявляется то
количество химического эквивалента
сильной кислоты, которое нужно добавить
к 1 литру (1 дм3) буферной системы,
чтобы уменьшить её рН на единицу.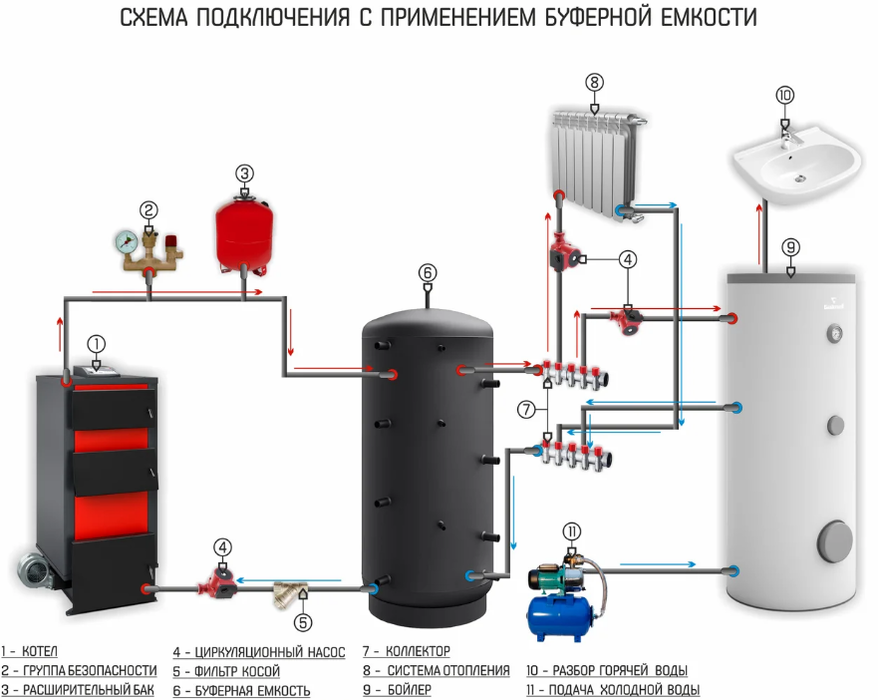
где n(1/z HA) – число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 – водородный показатель системы до добавления сильной кислоты;рН2 – водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм3) формула для подсчета буферной емкости будет иметь следующий вид:
где С(1/z НА) – молярная концентрация химического эквивалента сильной кислоты в добавляемом растворе; V(НА) – объем (л) добавленного раствора сильной кислоты;
V(буферной системы) – объем буферного раствора, к которому добавляют раствор кислоты.Соответственно буферной емкостью по основаниюявляется то количество химического эквивалента сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы вызвать увеличение ее рН на единицу:
где n(1/z В) – число молей химического эквивалента
основания, которое добавили к 1 литру
буферного раствора; рН1 –
водородный показатель раствора до
добавления основания; рН2 – водородный показатель раствора после
добавления основания.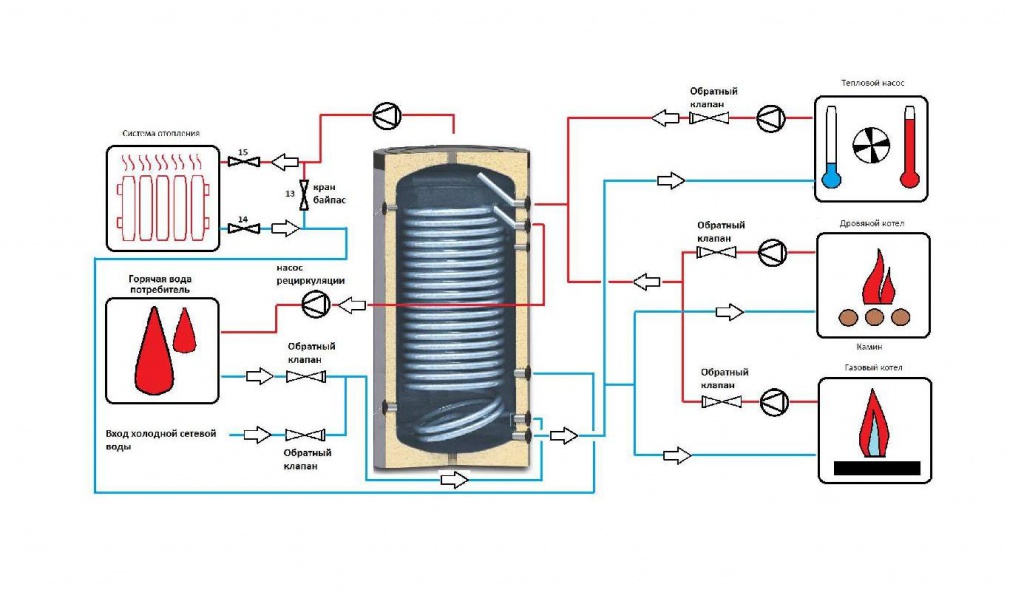
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
где С(1/z В) – молярная концентрация химического эквивалента основания в добавляемом растворе; V(В) – объем (л) добавленного раствора сильного основания; V(буферной системы) – объем буферного раствора (л), к которому добавляют раствор сильного основания.
Величина буферной емкости зависит от концентраций компонентов буферной системы и от их соотношения.
Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление небольших количеств сильной кислоты или щелочи не вызовет существенного изменения концентраций его компонентов, а значит и их соотношения.
Из буферных
растворов с одинаковым суммарным
содержанием химического количества их
компонентов наибольшей емкостью будут
обладать те, которые составлены из
равного числа молей слабой кислоты и
её соли или слабого основания и его соли
(рис.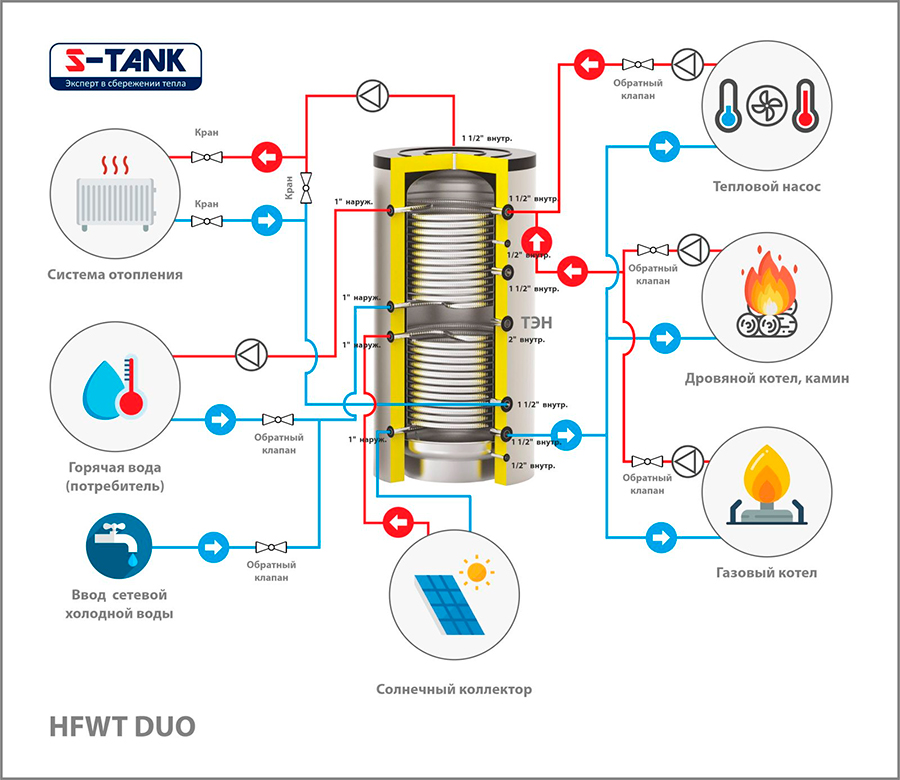
Рис. 35 Изменение буферной емкости (1) и изменение рН кислотной буферной системы при добавлении к ней определенного количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы будут иметь примерно одинаковые значения буферной емкости как по кислоте, так и по основанию.
Если же соотношение
концентраций компонентов буферной
системы не равно 1, то значения ее буферной
емкости по основанию и кислоте будут
отличаться друг от друга (причем тем
существеннее, чем в большей степени
соотношение С
Например, если в
кислотной буферной системе солевой
компоненты содержится больше чем слабой
кислоты, то ее буферная емкость по
кислоте будет выше чем по основанию,
т.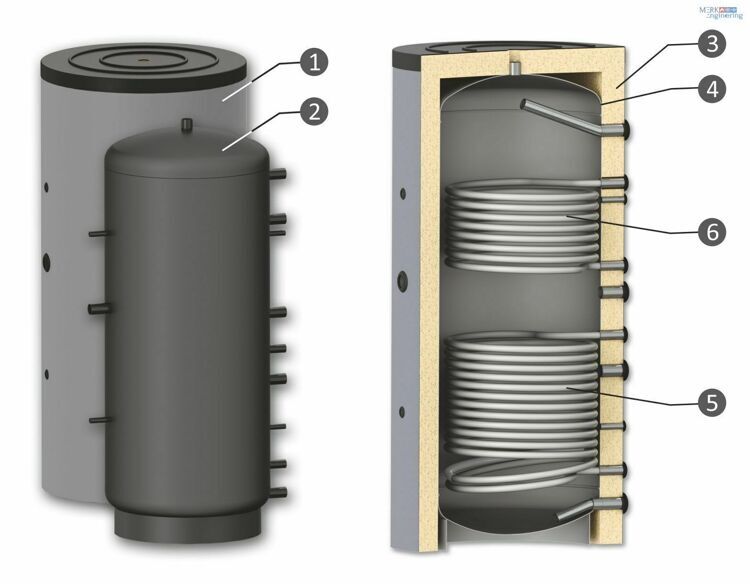 е. Вк.> Во.
е. Вк.> Во.
Соответственно буферная емкость по кислоте для основной буферной системы будет больше чем по основанию в том случае, если содержание солевой компоненты в этом случае будет меньше чем слабого основания.
Таким образом можно сделать вывод, что в данных случаях буферная емкость выше по тому веществу, которое реагирует с избыточным компонентом буферного раствора.
Если буферная система не обладает достаточной буферной емкостью, то ее можно повысить, увеличив концентрацию обоих компонентов в необходимое количество раз.
Буферная емкость и расчеты | ChemTalk
Основные понятия
В этом руководстве вы узнаете, что такое буферная емкость и как ее рассчитать. Мы также предоставим вам пошаговое руководство для примера проблемы.
Темы, освещенные в других статьях
- Что такое буферный раствор?
- Кислотно-основная химия
- Что такое рН? Формула и уравнение pH
- Слабые кислоты и слабые основания
Что такое буферная емкость?
Буферы устойчивы к изменениям рН, но они не непобедимы! Добавьте в буфер достаточное количество кислот или оснований, и его рН резко изменится.
Чтобы понять, почему это происходит, вспомним, что буфер представляет собой слабую кислоту и сопряженное с ней основание (или слабое основание и сопряженную с ним кислоту). Давайте рассмотрим пример одного из таких буферов: уксусная кислота и ее сопряженное основание, ацетат.
CH 3 COOH (водн.) ⇄ CH 3 COO – (водн.) + H + (водный)
Здесь, когда мы добавляем кислоту в буфер, ацетат будет поглощать добавленные протоны (H+) и образовывать уксусную кислоту, предотвращая концентрацию H+ в растворе и, следовательно, его pH от слишком большого изменения. Точно так же, когда мы добавляем основание в буфер, уксусная кислота будет реагировать с основанием с образованием ацетата и воды, предотвращая увеличение концентрации ОН.
Однако эти уксусные кислоты и ацетаты являются ограниченными ресурсами. Когда мы добавим много кислоты или основания, они израсходуют всю уксусную кислоту и ацетат буфера, что сделает буфер восприимчивым к резким изменениям pH.
Таким образом, буферная емкость — это количество кислоты или основания, которое мы можем добавить в буфер до того, как его рН резко изменится . Чем выше емкость, тем больше кислоты и основания мы можем добавить к нему, прежде чем его pH значительно изменится.
Весь смысл титрования заключается в превышении буферной емкости буфера! Источник: Викисклад.Общие тенденции буферной емкости
Чем выше концентрация слабой кислоты и сопряженного основания (или слабого основания и сопряженной кислоты) в буфере, тем выше будет его емкость. Например, буфер с [слабой кислотой] = 0,50 М ([ ] обозначает концентрацию) и [конъюгированное основание] = 0,30 М будет иметь более высокую емкость, чем буфер с [слабой кислотой] = 0,050 М и [конъюгированное основание] = 0,030 М.
Если буфер имеет более высокую концентрацию слабой кислоты, чем концентрация сопряженного основания, то он будет иметь более высокую емкость для добавления основания.
Аналогичным образом, если буфер имеет более высокую концентрацию сопряженного основания, чем концентрация слабой кислоты, то он будет иметь более высокую устойчивость к добавленной кислоте. Кровь с соотношением бикарбоната к угольной кислоте 20:1 является отличным примером буфера такого типа.
Кровь с соотношением бикарбоната к угольной кислоте 20:1 является отличным примером буфера такого типа.
Как рассчитать буферную емкость?
В более строгом смысле буферная емкость определяется как количество молей кислоты или основания, которое необходимо добавить к 1 литру буфера, чтобы его рН изменился на 1 единицу.
Следовательно, для расчета буферной емкости используем следующую формулу:
- β – буферная емкость (безразмерна)
- n – количество молей кислоты или основания (которые были добавлены в буфер) на литр буфера
- ΔpH – разница между начальным pH буфера и pH буфера после добавления кислоты или основания
Пример Задача о емкости буфера
Задача:
Дано 600 мл натрий-фосфатного буфера с рН 7,39.. Затем мы добавляем к нему 150 мл 0,2 М HCl, что придает буферному раствору новый рН 7,03. Какова емкость нашего фосфатно-натриевого буфера?
Решение:
Сначала найдем n, разделив количество молей HCl, которое мы добавили в буфер, на начальный объем буфера (в литрах, не забудьте!).
Количество молей HCl
Затем, следуя формуле, делим n на изменение рН раствора фосфата натрия.
Таким образом, буферная емкость нашего раствора фосфата натрия составляет 0,14.
Практические задачи
- Какова буферная емкость раствора, рН которого изменяется на 0,5 единицы при добавлении 0,5 моля кислоты к 2 литрам раствора.
- Какой объем 5М монопротонной кислоты необходимо добавить, чтобы изменить рН буферного раствора (концентрация = 0,22) с 6,7 до 6,3.
- Какое количество буферного раствора (концентрация 0,25) изменит рН на 0,73 единицы при добавлении 100 мл 3,2М Н 2 СО 4 .
- ЗАДАЧА: Используя нашу статью о таблицах ICE, рассчитайте pH буферного раствора (начальный pH = 7, крепость = 0,1, объем = 1 л), когда 100 мл 1M фосфорной кислоты (H 3 PO 4 ) добавлено (pKa1=2,15, pKa2=7,20, pKa3=незначительно).
Дополнительная литература
- Уравнение Гендерсона-Хассельбаха
- Сильные кислоты и основания
- Моноосновные, трипротонные и полипротоновые кислоты
Прочтите этот учебник, чтобы узнать, что такое емкость буфера и как ее рассчитать!
8.
 9 Емкость буфера и диапазон буфера
9 Емкость буфера и диапазон буфера- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 163841
Буферная емкость
Буферы характеризуются диапазоном рН, в котором они могут поддерживать более или менее постоянное значение рН, и буферной емкостью, т. е. количеством сильной кислоты или основания, которое может быть поглощено до того, как рН значительно изменится. Хотя полезный диапазон pH буфера сильно зависит от химических свойств слабой кислоты и слабого основания, используемых для приготовления буфера (т. е. от \(K\)), его буферная емкость зависит исключительно от концентрации соединений в буферный раствор. Чем более концентрирован буферный раствор, тем больше его буферная емкость. Как показано на рисунке \(\PageIndex{1}\), при добавлении \(NaOH\) к растворам, содержащим разные концентрации буфера уксусной кислоты/ацетата натрия, наблюдаемое изменение рН буфера обратно пропорционально концентрация буфера. Если буферная емкость в 10 раз больше, то буферный раствор может поглотить в 10 раз больше сильной кислоты или основания, прежде чем претерпит значительное изменение рН.
Как показано на рисунке \(\PageIndex{1}\), при добавлении \(NaOH\) к растворам, содержащим разные концентрации буфера уксусной кислоты/ацетата натрия, наблюдаемое изменение рН буфера обратно пропорционально концентрация буфера. Если буферная емкость в 10 раз больше, то буферный раствор может поглотить в 10 раз больше сильной кислоты или основания, прежде чем претерпит значительное изменение рН.
Рисунок \(\PageIndex{1}\): Влияние концентрации буфера на емкость буфера
Буфер поддерживает относительно постоянное значение pH при добавлении в раствор кислоты или основания. Добавление даже крошечных объемов 0,10 М \(NaOH\) к 100,0 мл дистиллированной воды приводит к очень большому изменению рН. По мере увеличения концентрации смеси буфера ацетата натрия/уксусной кислоты в соотношении 50:50 в растворе с 0,010 М до 1,00 М изменение рН, вызываемое добавлением того же объема раствора \(NaOH\), неуклонно уменьшается. . При концентрации буфера не менее 0,500 М добавление даже 25 мл раствора \(NaOH\) приводит лишь к относительно небольшому изменению рН.
Выбор подходящих компонентов для желаемого pH
Буферы работают лучше всего, когда pK a используемого конъюгата слабой кислоты близок к желаемому рабочему диапазону буфера. Это оказывается тем случаем, когда концентрации сопряженной кислоты и сопряженного основания примерно равны (примерно в 10 раз). Например, мы знаем, что K a для фтористоводородной кислоты составляет 6,6 x 10 -4 , поэтому его pK a = -log(6,6 x 10 -4 ) = 3,18. Таким образом, буфер с плавиковой кислотой будет работать лучше всего в буферном диапазоне pH = 3,18.
Для слабого основного аммиака (NH 3 ) значение K b составляет 1,8×10 -5 , что означает, что K a для диссоциации сопряженной кислоты, NH 4 900 26 + , is K w /K b =10 -14 /1,8×10 -5 = 5,6×10 -10 . Таким образом, pK a для NH 4 + = 9,25, поэтому буферы с использованием NH 4 + /NH 3 лучше всего работают при pH 9. .25. (Это всегда pK a сопряженной кислоты, которая определяет приблизительный pH для буферной системы, хотя это, очевидно, зависит от pK b сопряженного основания.)
.25. (Это всегда pK a сопряженной кислоты, которая определяет приблизительный pH для буферной системы, хотя это, очевидно, зависит от pK b сопряженного основания.)
Когда желаемый pH буферного раствора близок к pK a используемой сопряженной кислоты (т. е. когда количества сопряженной кислоты и сопряженного основания в растворе различаются примерно в 10 раз друг от друга), уравнение Хендерсона-Хассельбаха можно применить как простое приближение pH раствора, как мы увидим в следующем разделе.
Пример 1: буфер HF
В этом примере мы будем продолжать использовать буфер с плавиковой кислотой. Мы обсудим процесс приготовления буфера HF при рН 3,0. Мы можем использовать приближение Хендерсона-Хассельбальха для расчета необходимого соотношения F – и HF.
\[pH = pKa + \log\dfrac{[Основание]}{[Кислота]}\]
\[3,0 = 3,18 + \log\dfrac{[Основание]}{[Кислота]}\]
\[\log\dfrac{[Основа]}{[Кислота]} = -0,18\]
\[\dfrac{[Основа]}{[Кислота]} = 10^{-0,18}\]
\[\dfrac{[Основание]}{[Кислота]} = 0,66\]
Это просто соотношение концентраций сопряженного основания и сопряженной кислоты, которые нам понадобятся в нашем растворе. Однако что, если у нас есть 100 мл 1 М HF и мы хотим приготовить буфер с использованием NaF? Сколько фторида натрия нам нужно добавить, чтобы создать буфер с указанным pH (3,0)?
Однако что, если у нас есть 100 мл 1 М HF и мы хотим приготовить буфер с использованием NaF? Сколько фторида натрия нам нужно добавить, чтобы создать буфер с указанным pH (3,0)?
Мы знаем из нашего расчета Хендерсона-Хассельбальха, что отношение нашего основания/кислоты должно быть равно 0,66. Из таблицы молярных масс, такой как таблица Менделеева, мы можем рассчитать молярную массу NaF, равную 41,9.+_{(водн.)}\]
Мы могли бы использовать таблицы ICE для расчета концентрации F – по диссоциации HF, но, поскольку K a настолько мала, мы можем приблизиться к тому, что практически весь HF будет остаются недиссоциированными, поэтому количество F – в растворе от диссоциации HF будет пренебрежимо мало. Таким образом, [HF] составляет около 1 M, а [F – ] близко к 0. Это будет особенно верно, если мы добавим больше F – , добавление которого еще больше подавит диссоциацию HF. .
Мы хотим, чтобы отношение База/Кислота было 0,66, поэтому нам потребуется [Основа]/1M = 0,66. Таким образом, [F – ] должно быть около 0,66 М. Таким образом, на 100 мл раствора необходимо добавить 0,066 моль (0,1 л x 0,66 М) F – . Поскольку мы добавляем NaF в качестве источника F – и поскольку NaF полностью диссоциирует в воде, нам потребуется 0,066 моль NaF. Таким образом, 0,066 моль x 41,99 г/моль = 2,767 г.
Таким образом, [F – ] должно быть около 0,66 М. Таким образом, на 100 мл раствора необходимо добавить 0,066 моль (0,1 л x 0,66 М) F – . Поскольку мы добавляем NaF в качестве источника F – и поскольку NaF полностью диссоциирует в воде, нам потребуется 0,066 моль NaF. Таким образом, 0,066 моль x 41,99 г/моль = 2,767 г.
Обратите внимание, что, поскольку конъюгированная кислота и сопряженное основание смешиваются в одном и том же объеме раствора в буфере, соотношение «основание/кислота» остается тем же, независимо от того, используем ли мы соотношение «концентрация основания к концентрации кислоты», ИЛИ отношение «молей основания к молям кислоты». Оказывается, рН раствора не зависит от объема! (Это верно только до тех пор, пока раствор не становится настолько разбавленным, что автоионизация воды становится важным источником H + или ОН – . Однако такие разбавленные растворы редко используются в качестве буферов.)
Ссылки
- Brown, et al.
 Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г. .
Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г. . - Чанг, Рэймонд. Общая химия: основные понятия. 3-е изд. Нью-Йорк: Макгроу Хилл, 2003 г. .
- Петруччи и др. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson/Prentice Hall, 2007.
Внешние ссылки
- Урбанский, Эдвард Т.; Шок, Майкл Р. «Понимание, получение и расчет емкости буфера».
Авторы
- Хосе Пьетри (UCD), Дональд Лэнд (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Метки



 Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г.
Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г.