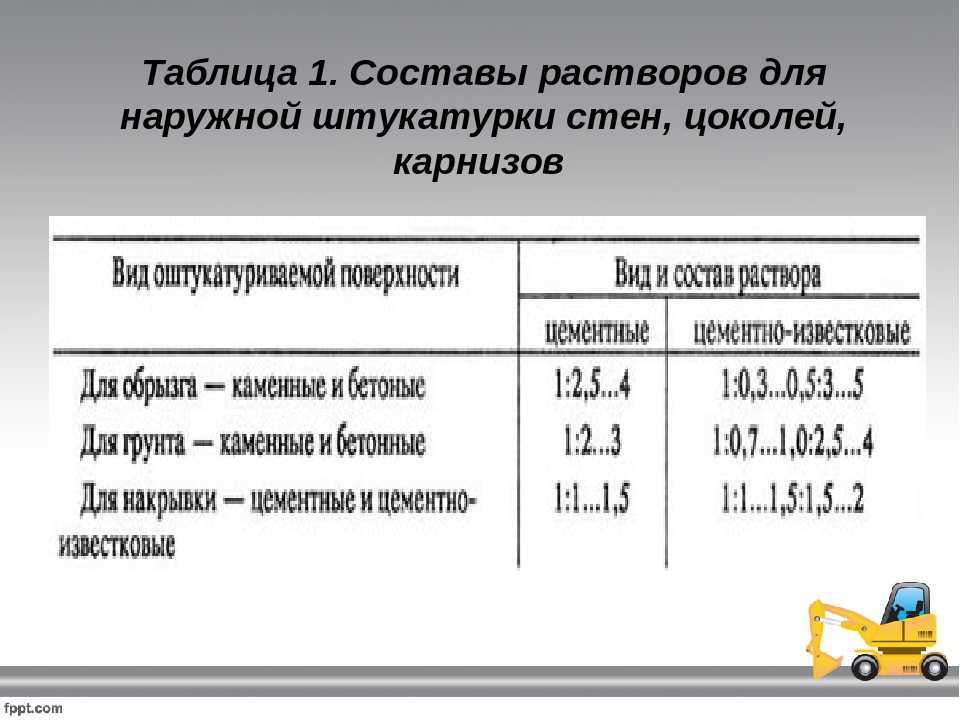
Какой раствор нужен для кладки кирпича
Среди строителей самым используемым и востребованным инструментом остается кирпич, он может придать стенам стойкость и долгий срок эксплуатации. Чтобы стены служили долго, необходимо правильно заложить кирпич, а для этого нужен хороший раствор. О них и пойдет речь в этой статье.
Приготовление
Перед началом готовки растворов следует проверить и сделать некоторые приготовления:
- Приготовить заранее чистый, просеянный песок, тогда будет достаточная вязкость с вяжущим компонентом и застывший раствор будет иметь достаточную прочность;
- Эластичность также достигается благодаря правильным пропорциям между цементом и дополнительными составляющими. Кроме этого, стоит запомнить одно правило – подвижность будет настолько большей, насколько цемент в смеси будет превышать другие вещества;
- Вместо песка можно брать глину или различные смеси. Такие растворы будут очень пластичными. Для использования такого раствора лучше хорошо знать способ их приготовления (особенно с глиной), использовать их можно не во всех ситуациях.
 Например, если необходимы полосные кирпичи, сочетать их с таким раствором нельзя, поскольку, кирпичи будут впитывать в себя весь раствор до того, как он успеет засохнуть.
Например, если необходимы полосные кирпичи, сочетать их с таким раствором нельзя, поскольку, кирпичи будут впитывать в себя весь раствор до того, как он успеет засохнуть.
Известковые смеси
Для некоторых ситуаций требуется смеси с высокой пластичностью, чем цемент не всегда может похвастаться. С такой задачей справится состав сделанный из извести и песка. Необходимо смешать эти два элемента в воде до состояния густой консистенции. Далее снова все перемешать пока смесь снова не станет однородной без комков.
Теплые растворы для керамоблока
Керамоблок имеет прекрасные показатели изоляции и теплосохранения, благодаря этому он пользуется большой популярностью среди строителей. Также, он довольно экономный, один такой блок может заменить до 16 кирпичей, а во время кладки расход раствора намного меньший. Но, для правильной закладки такого материала необходимы специальные смеси. Готовая стена будет однородной благодаря особенностям керамики, а с подходящим раствором, ничем не уступит кирпичной.
Цементные растворы
Такие растворы делаются из песка и цемента и заливаются водой. Соотношение компонентов может быть разным, напрямую зависит от цемента – его типа и качества. Смесь смешивается и постепенно заполняется водой. Эту массу необходимо размешивать пока не будет получены густая однородная масса. Хоть это проверенный и надежный вариант, он не всегда является подходящим, для некоторых конструкций нужны подвижные смеси, каким цементный раствор не является.
Порядок приготовления смеси:
- Известь очищается через сито, заливается водой и мешается до густого состояния;
- Песок и цемент высыпать в емкость, залить водой. Если добавить известь или другие материалы, получаемый раствор будет иметь большую пластичность. Использовать такую смесь можно с любым кирпичом.
Цементно-известковый раствор
Сочетание извести и цемента придают раствору большую прочность и долгий срок эксплуатации. Они хорошо контактируют и сцепляются с кирпичом всех типов. Поэтому такие смеси используют не только для сооружения стен, но и для штукатурки. Для замешивания такого раствора вода не нужна, вместо нее используется известковое молоко, оно обеспечивает большую тягучесть и сцепление с поверхностями.
Поэтому такие смеси используют не только для сооружения стен, но и для штукатурки. Для замешивания такого раствора вода не нужна, вместо нее используется известковое молоко, оно обеспечивает большую тягучесть и сцепление с поверхностями.
Цементно-глиняный раствор
Раствор сделанный с использованием глины, имеет меньшую прочность, по сравнению с обычным цементным, но обеспечивает большую термоустойчивость. Используют такие растворы, в основном, для отделки кирпичных сооружений и штукатурки. Качество такой кладки зависит от чистоты глины, поэтому перед готовкой самого раствора, лучше лишний раз просеять глину для удаления лишних частиц.
Простой раствор
Самый простейший раствор делается из вязкого вещества и песка. В качестве вязки можно использовать цемент или известь, иногда используют и глину, но такой материал применяется только в особых случаях специалистами. Примерные пропорции приготовления: одна часть цемента против трех частей песка. Результат перемешивается и добавляется вода. Мешать необходимо до тез пор, пока не получится нужная консистенция и плотность материала.
Мешать необходимо до тез пор, пока не получится нужная консистенция и плотность материала.
Сложный раствор
Более сложные замесы из себя представляют вяжущие материалы с несколькими другими компонентами. Примерами таких растворов есть цементно-известные и цементно-глиняные растворы. Благодаря таким сочетаниям, раствор получается достаточно крепким и подвижным, но в то же время и надежным.
Если нужна максимальная пластичность, то добавляется глина, тогда состав будет легко накладываться и не расплываться. Различные пластификаторы полезны при кладке стен и фасадов, они довольно экономна и при налаживании. Пластификаторы хорошо ложатся на предыдущий ряд. Многие строители рекомендуют использовать различные смеси с неоднородным составом, чтобы добиться лучшей пластичности и прочности материалов.
Подвижности смесей
Эта характеристика очень важная для любой смеси, независимо от цели ее использования. Подвижность будет напрямую зависеть от качества материалов. Определить показатель текучести можно с помощью небольшого конуса на 30 градусов, высотой около 15-20 см. погрузить его в готовый раствор и вымерять на сколько он в него погрузился, от результата будет зависеть хороша ли смесь по подвижности.
Определить показатель текучести можно с помощью небольшого конуса на 30 градусов, высотой около 15-20 см. погрузить его в готовый раствор и вымерять на сколько он в него погрузился, от результата будет зависеть хороша ли смесь по подвижности.
Если используются пустотелые кирпичи, то для них вполне подойдет подвижность до 10 см. Для полнотелого необходимо немного больше – 10-14 см. Также, стоит напомнить, что подвижность необходимо увеличивать на 10-15 см. при высоких температурах, это необходимо для того чтобы, раствор не терял своих качеств.
Заключение
Если планируете ремонт, то стоит подобрать подходящий раствор для крепления кирпичей. Выбирать стоит учитывать качество используемых материалов, в каких климатических условиях будет проходить строительство, какое сооружение планируется построить. Если знать особенности возможных растворов, то подобрать подходящий не займет много времени.
Раствор для стяжки пола: марка, пропорции, расход цемента
Практически все современные напольные покрытия требуют ровного основания, которого проще всего добиться сделав стяжку пола. Процесс потребует много времени. До укладки покрытия, скорее всего, придется ждать около месяца, но пол будет надежным. Сделать раствор для стяжки дешевле всего из смеси песка и цемента. Хотя есть и другие варианты.
Процесс потребует много времени. До укладки покрытия, скорее всего, придется ждать около месяца, но пол будет надежным. Сделать раствор для стяжки дешевле всего из смеси песка и цемента. Хотя есть и другие варианты.
Содержание статьи
- 1 Состав раствора для стяжки пола: ЦПС или бетон с гравием
- 2 Марка цементно-песчаного раствора для стяжки: выбор прочности
- 3 Пропорции классической стяжки из ЦПС
- 3.1 Какой брать песок
- 3.2 Последовательность замеса
- 3.3 Готовый раствор или пескоцементная смесь
- 4 Добавки: нужны или нет?
- 4.1 Пластифицирующие добавки
- 4.2 Микроармирование
- 5 Расчет объема раствора для стяжки
- 6 Расход цемента на стяжку
Состав раствора для стяжки пола: ЦПС или бетон с гравием
Стяжку пола чаще всего делают из цементно-песчаной смеси. То есть, раствор содержит только цемент и песок, иногда с дополнительными добавками. В классическом варианте стяжку заливают только смешав песок и цемент в определенной пропорции, смесь разводят водой. Называют такой раствор еще пескобетон. В том смысле, что в качестве наполнителя использован только песок. Это наиболее дешевый вариант, но не единственный.
Называют такой раствор еще пескобетон. В том смысле, что в качестве наполнителя использован только песок. Это наиболее дешевый вариант, но не единственный.
При толщине стяжки более 5 см, могут использовать бетон с заполнителем из мелкого щебня. Бетон классический: к песку и цементу добавляется какое-то количество щебня. Его размеры — не более половины толщины стяжки. Так как минимальные размеры щебня — 20-25 мм, вот и вырисовывается минимальная толщина стяжки из бетона — 50 мм.
Какой раствор для стяжки пола лучше использовать? Пескобетон или бетон с заполнителем из мелкого гравияНо бетон с гравием более тяжелый и дорогой. Его плюс в том, что он меньше подвержен образованию трещин при усадке и поэтому бетоном заливают теплые полы. Тут малое количество трещин критически важно. Для обычной выравнивающей стяжки наличие усадочных трещин — не такая уж проблема. Бюджет же, обычно, ограничен и поэтому чаще выбирают именно цементно-песчаную смесь.
Иногда для стяжки используют составы на основе гипса.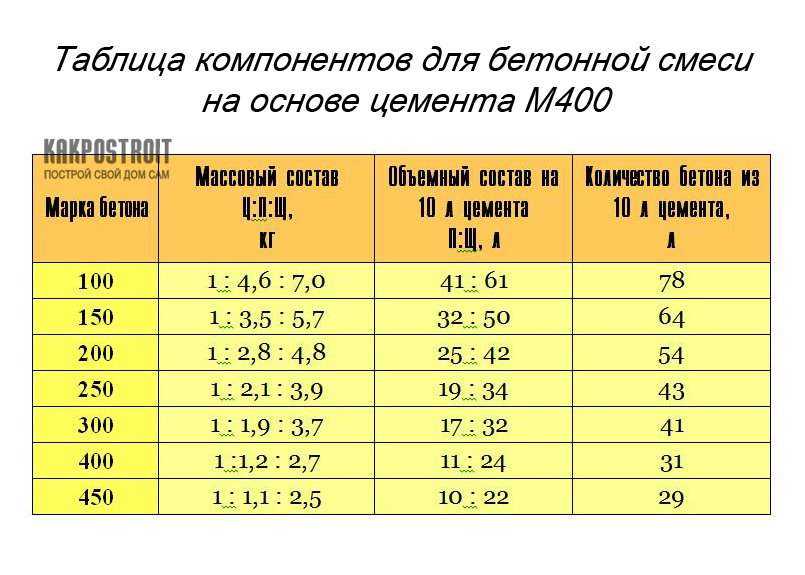 Но они боятся влаги, раствор имеет меньший срок жизни, прочность поверхности ниже. Все это делает их непопулярными. Раствор для стяжки на основе гипса в последние годы — редкость.
Но они боятся влаги, раствор имеет меньший срок жизни, прочность поверхности ниже. Все это делает их непопулярными. Раствор для стяжки на основе гипса в последние годы — редкость.
Марка цементно-песчаного раствора для стяжки: выбор прочности
Какую марку цементно-песчаного раствора используют для стяжки? Раньше могли класть М50 или М75. Сейчас минимально — М150. Почему? Потому что, прежде всего, требования к отделке были гораздо ниже. То, что раньше считалось нормальным — небольшие ямы, каверны, трещины — сейчас неприемлемо. И это не только «эстетика». В большей степени это требования производителей отделочных покрытий. Они требуют практически идеальную поверхность, которая не пылит, а такую дать может только раствор прочностью не ниже М100.
Марка цементно-песчаного раствора для стяжки выбирается исходя из укладываемого напольного покрытияЕсть и другие причины того, что марку раствора используют более высокую. Первая. Никто не уверен в качестве цемента, так что предпочитают перестраховаться, чем переделывать заново. Вторая — современные покрытия требуют ровного прочного основания и раствор для стяжки должен быть прочным. И третье — под самовыравнивающиеся составы или под современный плиточный клей с полимерными добавками низкую марку просто не уложишь. Чтобы две части покрытия не расслоились, разница в прочности должна быть не более 50 единиц. То есть, если выравнивающая смесь имеет прочность М250, раствор для стяжки пола должен быть прочностью М200 и не ниже. То же самое с плиточным клеем. Так что обратите на это внимание.
Вторая — современные покрытия требуют ровного прочного основания и раствор для стяжки должен быть прочным. И третье — под самовыравнивающиеся составы или под современный плиточный клей с полимерными добавками низкую марку просто не уложишь. Чтобы две части покрытия не расслоились, разница в прочности должна быть не более 50 единиц. То есть, если выравнивающая смесь имеет прочность М250, раствор для стяжки пола должен быть прочностью М200 и не ниже. То же самое с плиточным клеем. Так что обратите на это внимание.
Пропорции классической стяжки из ЦПС
Классический раствор для стяжки пола, как уже говорили, это цемент с песком, разведенный водой. Пропорция (количество песка на единицу цемента) зависит от требуемой прочности стяжки и марки используемого цемента. Чтобы поверхность пола была прочной, используют недешевый портландцемент марки М400 и выше.
Пропорции раствора для стяжки пола для М150, М200 и М300 при использовании цемента разных марокДля стяжки пола в подсобных помещениях можно использовать и более дешевый М300. Его пойдет немного больше, но экономия будет. Для основания в доме или квартире под современные покрытия такой цемент лучше не берите. Переделка потребует значительно больше сэкономленного на цементе.
Его пойдет немного больше, но экономия будет. Для основания в доме или квартире под современные покрытия такой цемент лучше не берите. Переделка потребует значительно больше сэкономленного на цементе.
Новичкам в строительном деле кажется, что если взять больше цемента, будет более прочная стяжка. А вот и нет. Для прочности важно правильное соотношение всех компонентов, а избыточное количество цемента может стать причиной понижения прочности. Если хотите более прочную стяжку — используйте качественный цемент и точно отмеряйте пропорции. Воды, кстати, больше брать тоже не стоит. Это повысит текучесть раствора, но увеличит количество усадочных трещин. Так что еще раз: чтобы получить прочный и надежный бетон, надо точно соблюдать пропорции.
Какой брать песок
Песок лучше брать речной, причем — промытый, как минимум двух фракций: крупный и средний. Почему речной? Потому что он имеет острые грани, а это снижает вероятность того, что он осядет в нижние слои. С этим понятно. А зачем мытый? В нем минимум пыли. Чем меньше пыли, тем выше прочность раствора. Песок также нужен разного размера, чтобы прочность раствора была нормальной.
С этим понятно. А зачем мытый? В нем минимум пыли. Чем меньше пыли, тем выше прочность раствора. Песок также нужен разного размера, чтобы прочность раствора была нормальной.
Если на пол собираетесь укладывать дорогое покрытие с высокими требованиями к прочности основания (паркет, паркетная или инженерная доска, виниловая плитка) лучше брать именно такой песок. Меньше будет проблем.
Последовательность замеса
Когда делают раствор для стяжки пола, сначала перемешивают сухие компоненты — цемент и песок. При ручном замесе (в корыте), что закидывать в первую очередь — цемент или песок, особой разницы нет. Если используют бетономешалку, сразу закидывают песок и крутят его пару минут без цемента. Затем, постепенно, обычно лопатами добавляют цемент. После каждой порции ждут, пока он более-менее равномерно распределится, затем закидывают следующую. Добавив все количество вяжущего, перемешивают пока не получат равномерно окрашенную смесь.
Когда сухие компоненты перемешались до получения однородной массы серого цвета, понемногу вводят воду. Ее считают от количества цемента. Обычно на 1 часть цемента берут 0,45-0,55 частей воды. Почему не указывают точно? Потому что количество воды зависит от влажности песка. А воды желательно наливать минимум: так меньше будет трещин при высыхании.
Готовый раствор или пескоцементная смесь
Те, кто хоть раз самостоятельно замешивали ЦПС или бетон, чаще склоняются к покупке готового бетона. Причем не смеси песка и цемента в мешках, а именно бетона из бетономешалки. Да, по деньгам выходит дороже, но времени и сил требуется в разы меньше. Еще один плюс такого решения: заливка без холодных швов. А это значит — меньше трещин и проблем в дальнейшем. Следующий плюс — бетономешалки могут доставить раствор на нужный этаж. Представьте, что вам надо перетаскать пару тонн песка и цемента. Даже если есть грузовой лифт — это нелегко. Может быть и затратно, если платить подсобникам. Поднимать по лестнице «на плечах» — это вообще проблема.
Еще один плюс такого решения: заливка без холодных швов. А это значит — меньше трещин и проблем в дальнейшем. Следующий плюс — бетономешалки могут доставить раствор на нужный этаж. Представьте, что вам надо перетаскать пару тонн песка и цемента. Даже если есть грузовой лифт — это нелегко. Может быть и затратно, если платить подсобникам. Поднимать по лестнице «на плечах» — это вообще проблема.
В чем плюсы покупки готовой пескоцементной смеси в мешках? В том, что пропорция выдержана точно, песок использован нескольких фракций и в нужных количествах. То есть, стяжка гарантированно будет иметь нужную прочность. Минус — цена. Купить то же количество цемента и песка можно за гораздо меньшую сумму. Это если не заморачиваться с фракциями песка. Если же озаботиться и этим, то экономия станет меньше: не все фракции стоят дешево.
youtube.com/embed/SXEMFEEK6SQ?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””>Добавки: нужны или нет?
В классический раствор для стяжки пола могут рекомендовать добавить пластификаторы и фиброволокно или другие вещества для микроармирования. Нужны они или нет? Сначала надо понять, что это и для чего.
Делая раствор для стяжки можно обойтись только песком и цементомПластифицирующие добавки
Пластификаторы — вещества, которые повышают пластичность ЦПС. Работать с такими растворами проще. Бетон с пластификатором лучше ложится, легче выравнивается, дает более гладкую поверхность. Вообще, если все компоненты нормального качества, хорошо перемешаны, то и с затворенными водой с ними работать несложно. С добавками, конечно, проще. Но фабричные пластификаторы стоят немалых денег, а это увеличивает стоимость стяжки. Добавлять их надо в небольших количествах, но счет при заливке пола в доме идет на кубометры, так что затраты будут ощутимы.
Как обычно, умельцы нашли замену фабричным пластификаторам. В раствор добавляют обычное мыло. Расход его совсем небольшой — стакан или около того на одну бетономешалку. Пластичность раствора повышается, так что многие применяют этот тип добавки. Для новичков стоит сказать: не превышайте рекомендованную дозу. Раствор лучше не станет, а хуже вполне может быть. Мыло повышает пластичность, «смазывая» песок, уменьшая его «сцепление» с цементной жижей. Превышение дозировки может привести к снижению прочности стяжки. Так что будьте точны.
Микроармирование
Как известно, при высыхании цементно-песчаный раствор дает усадку. Величина усадки — от 1,5% до 3% от объема. Конкретно процент усадки зависит от количества посторонних примесей (если песок мытый, усадка будет меньше), верно подобранного состава заполнителя (в данном случае песка), точно соблюденных пропорций и еще ряда условий и факторов.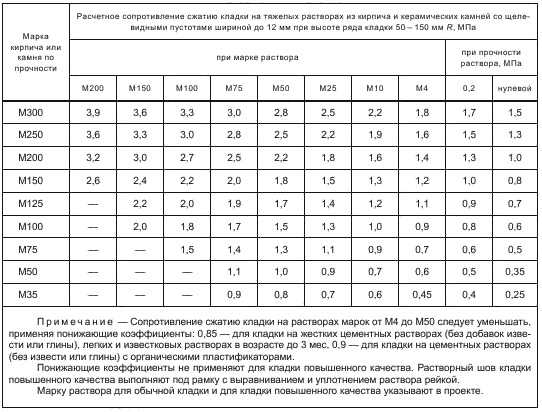
Все бы ничего, но при усадке в растворе образуются трещины. Они есть всегда, только большего или меньшего размера, в большем или меньшем количестве. Чтобы уменьшить количество трещин, в раствор добавляют материалы для микроармирования. Чаще всего в быту используется фиброволокно. Оно бывает:
- стекловолоконное;
- базальтовое;
- металлическое;
- полипропиленовое.
Наиболее популярно для бытовых целей полипропиленовое фиброволокно. Оно самое недорогое и дает неплохой результат. Как оно работает? В 100 граммах этой добавки содержится огромное количество синтетических волокон. Они очень тонкие, но синтетика отличается высокой прочностью. Эти волокна хаотично, но равномерно распределяются по всей толще раствора. В бетоне они образуют в пространстве подобие решетки. При возникновении напряжений при высыхании стяжки, они связывают части раствора между собой, уменьшая количество и размеры трещин.
Второй эффект от фиброволокна — более гладкая и прочная поверхность. Так что эта добавка в раствор для стяжки пола более полезна и ее точно стоит использовать. Но снова-таки, строго по рекомендациям. Кажется, что если добавить больше фибры, то трещин будет меньше, но нет. Снизится прочность стяжки.
Так что эта добавка в раствор для стяжки пола более полезна и ее точно стоит использовать. Но снова-таки, строго по рекомендациям. Кажется, что если добавить больше фибры, то трещин будет меньше, но нет. Снизится прочность стяжки.
Расчет объема раствора для стяжки
Чтобы определиться с объемами материалов, надо знать сколько потребуется раствора. Затем, используя необходимые пропорции для стяжки, можно будет вычислить примерное количество песка и цемента. Чтобы провести расчет раствора, нужно знать площадь, на которую будем заливать раствор и толщину слоя.
Площадь заливки вычислить просто: длину комнаты в метрах умножаем на ее ширину. Получаем площадь. Вы уже должны знать максимальный и минимальный слой стяжки.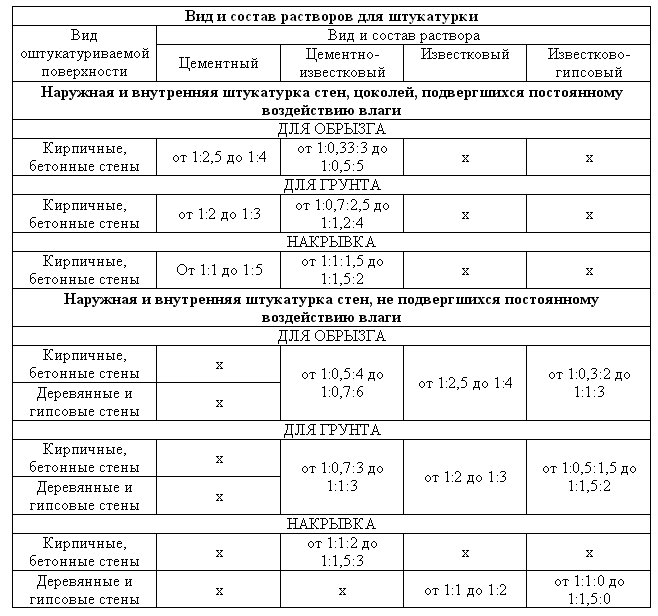 По степени ровности основания, можно определить примерно среднюю толщину. Если найденную площадь умножить на толщину стяжки и получим требуемый объем раствора.
По степени ровности основания, можно определить примерно среднюю толщину. Если найденную площадь умножить на толщину стяжки и получим требуемый объем раствора.
Давайте рассмотрим пример. Комната 2,8 м на 3,4 м, толщина стяжки — 6 см. Находим площадь заливки — 2,8 * 3,4 = 9,52 м². Чтобы получить кубометры бетона, который нам потребуется, надо 6 см перевести в метры. Для этого 6 см делим на 100. Получаем 0,06 м. Теперь площадь заливки умножаем на эту цифру: 9,52 * 0,06 = 0,5712 м3. То есть, на площадь комнаты 9,5 квадратов при толщине стяжки 6 см потребуется примерно 0,6 кубометра раствора. С таким объемом раствор для стяжки пола точно придется замешивать самостоятельно. Ни один бетонный завод не будет доставлять меньше кубометра раствора.
Если заливать стяжку надо будет сразу в нескольких помещениях, можно сначала посчитать площадь всех помещений под заливку, затем умножить на толщину стяжки. Этот вариант возможен, если нет больших перепадов по высоте между разными помещениями.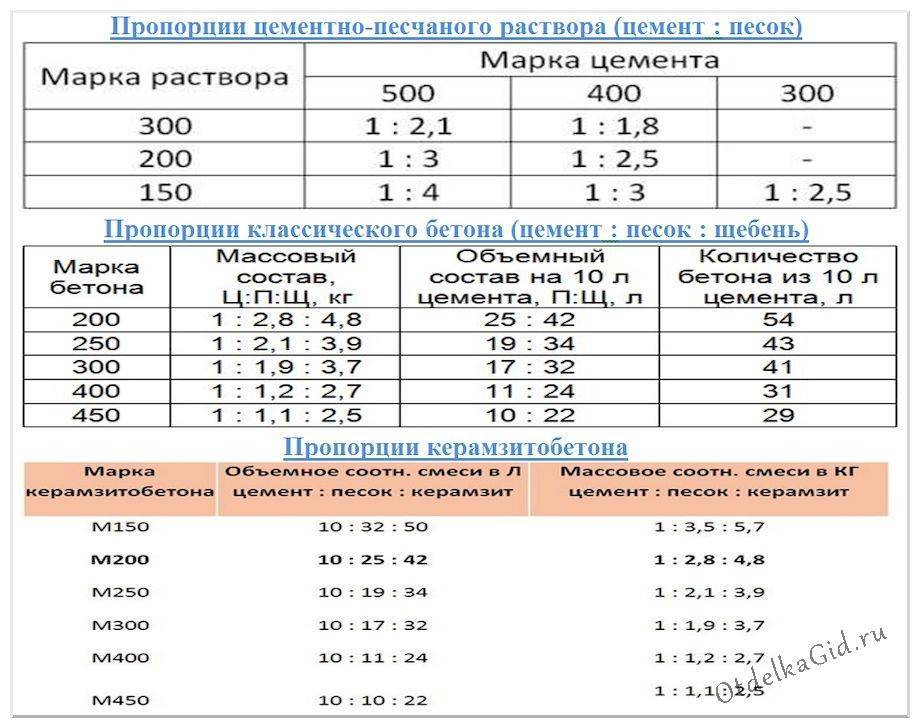 Если в одной комнате стяжка будет 6 см, в другой 9 см, лучше считать объем для каждого помещения отдельно, а затем сложить результаты.
Если в одной комнате стяжка будет 6 см, в другой 9 см, лучше считать объем для каждого помещения отдельно, а затем сложить результаты.
Расход цемента на стяжку
Если решили раствор для стяжки замешивать самостоятельно, надо определиться с количеством цемента, который вам потребуется. Его можно высчитать исходя из найденного объема раствора. Есть таблицы, в которых приведен расход цемента на стяжку в зависимости от марки раствора и связующего.
Количество цемента в одном кубометре раствора для стяжкиРассчитаем количество цемента для одного куба стяжки из пескобетона марки М150. Если использовать будем цемент М400, на куб уйдет 400 килограммов цемента (по таблице). Чтобы найти сколько нужно будет цемента для описанного выше примера, надо найденный объем раствора умножить на норму: 0,6 м³ * 400 кг = 240 кг. То есть, на эту комнату надо будет 240 килограммов цемента. Чтобы определить количество мешков, делим эту цифру на массу цемента в мешке.
То есть, на эту комнату надо будет 240 килограммов цемента. Чтобы определить количество мешков, делим эту цифру на массу цемента в мешке.
- Если в мешке 50 кг цемента, надо будет: 240 кг / 50 кг = 4,8 мешка.
- При фасовке по 25 кг: 240 кг / 25 кг = 9,6 мешков.
Другая фасовка тоже бывает, но встречается редко. Когда определитесь с маркой и производителем, можно будет точно рассчитать количество мешков цемента на стяжку пола.
Как рассчитать количество цемента на кубометр пескаЕще расход цемента можно посчитать исходя из имеющегося количества песка. Мало ли. Может кто-то будет закупать песок и чтобы не оставалось остатков, его надо весь израсходовать.
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 5 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность – это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
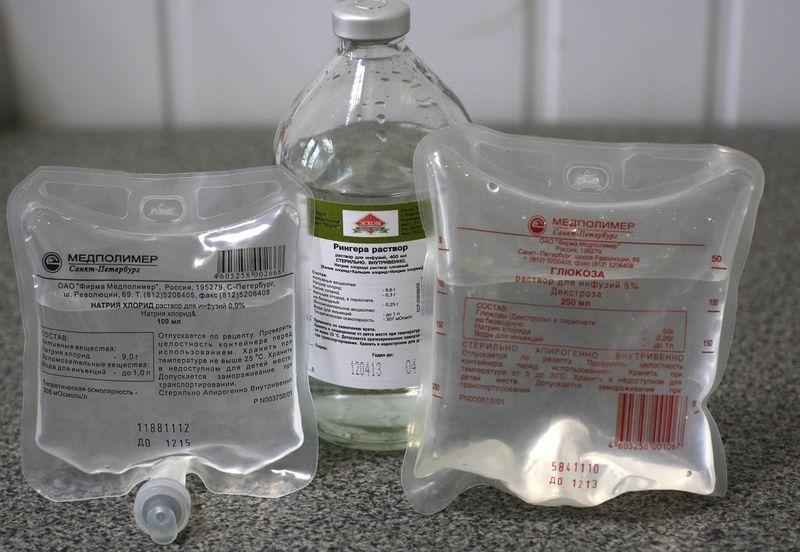
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Дано: объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем. умножение объема раствора на его молярность.
умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9.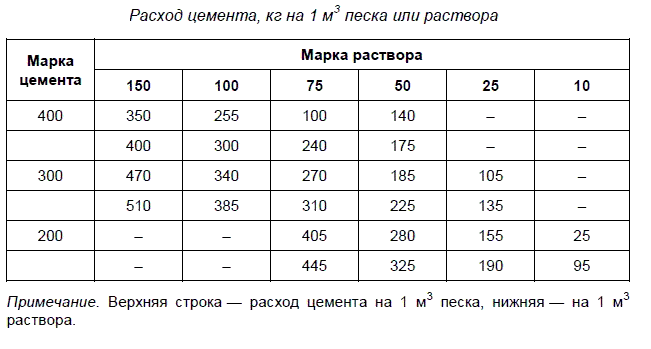 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 дает раствор, содержащий 1 05 O 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН –
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. – (водн.) \)
– (водн.) \)
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO 3 − ions, so a 0.032 M In(NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 – – это, [в 3 + ] = 0,0323 М.0323 М.0323 M.0323. − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН – ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М Уравнение 12.
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств указаны инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги

- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98550
- Количественное описание концентрации растворов
- Ответить
41,6 ммоль
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
- Ответить
2,3 г NaCl
- Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 12. 1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
5.2: Растворы и разведения — Химия LibreTexts
Цели обучения
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4.5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер\]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Расчет количества молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.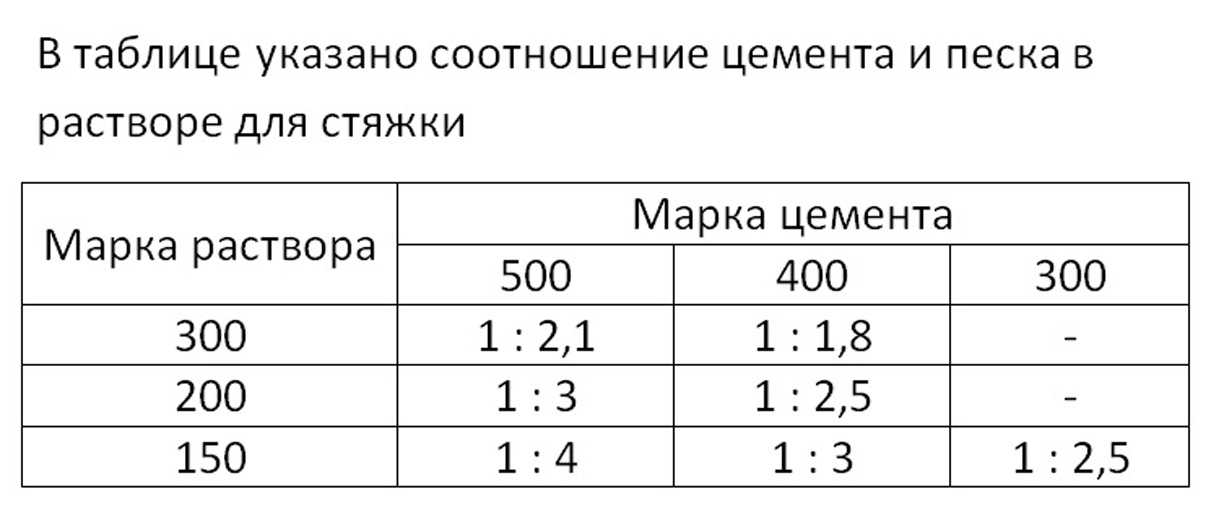 5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
Расчеты с использованием молярности (M): расчеты с использованием молярности (M), YouTube (opens in new window) [youtu.be]
или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммы растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммы растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 •2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (М)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность – это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.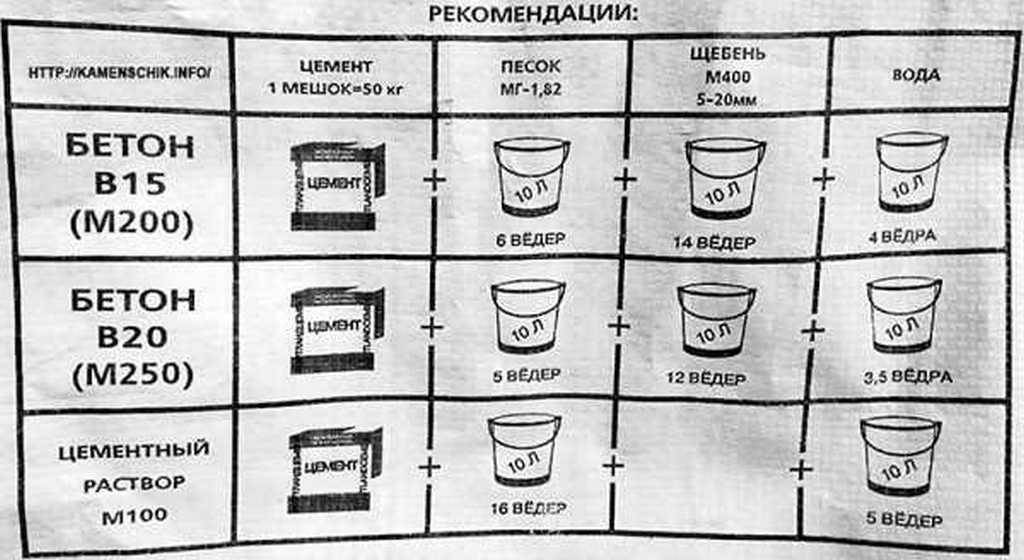
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М исходного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \номер\]
При определении необходимого объема маточного раствора мы должны были разделить желаемое количество молей глюкозы по концентрации исходного раствора для получения соответствующих единиц.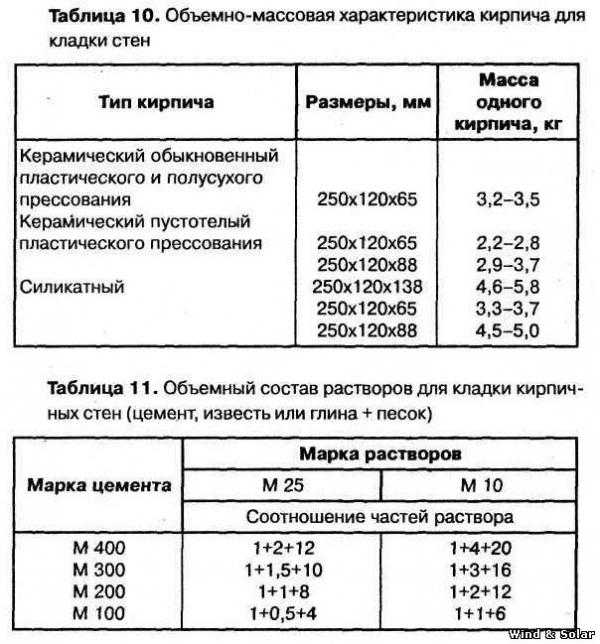 Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного изображения раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 – также должен быть 1,43 м, потому что один CR 2 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444 4. 70298. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 produces three ions when dissolved in water (2NH 4 + + 1Cr 2 O 7 2 − ), the total concentration of ions в растворе 3 × 1,43 M = 4,29 M.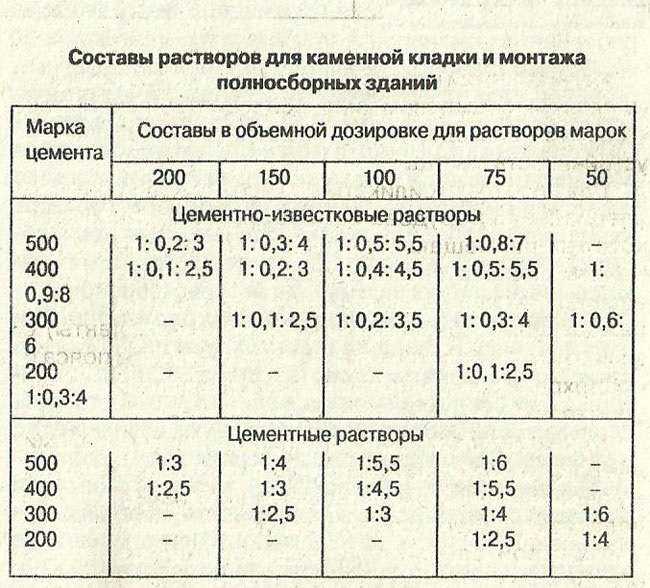
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. – (водн.) \)
– (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН – ] = 0,21 М.
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO 3 − ions, so a 0.032 M In(NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 – – это, [в 3 + ] = 0,0323 М.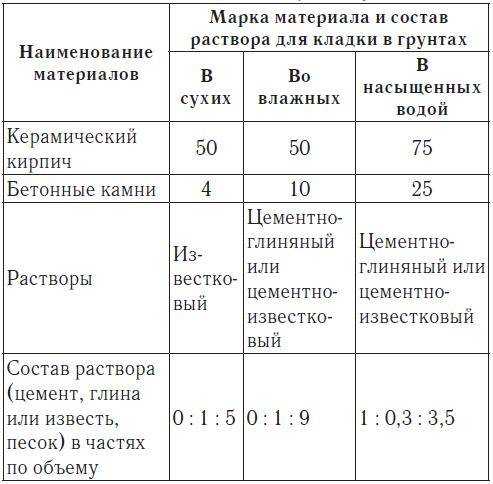 0323 М.0323 M.0323. − ] = 0,096 М.
0323 М.0323 M.0323. − ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер \]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора.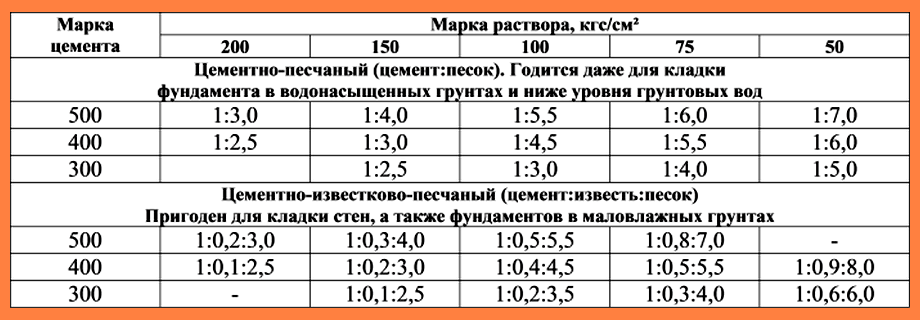 Концентрации обычно выражают в виде молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0047 ) до желаемого конечного объема.
Концентрации обычно выражают в виде молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0047 ) до желаемого конечного объема.
Авторы и авторство
5.2: Solutions and Dilutions распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.


 Например, если необходимы полосные кирпичи, сочетать их с таким раствором нельзя, поскольку, кирпичи будут впитывать в себя весь раствор до того, как он успеет засохнуть.
Например, если необходимы полосные кирпичи, сочетать их с таким раствором нельзя, поскольку, кирпичи будут впитывать в себя весь раствор до того, как он успеет засохнуть.

 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.

 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?