Порог стыковочный
- Главная
- ПОРОЖКИ ДЛЯ СТЫКОВКИ НАПОЛЬНЫХ ПОКРЫТИЙ
- Порог стыковочный
Сортировкапо возрастанию ценыпо убыванию ценысначала новыепо названию
Предзаказ
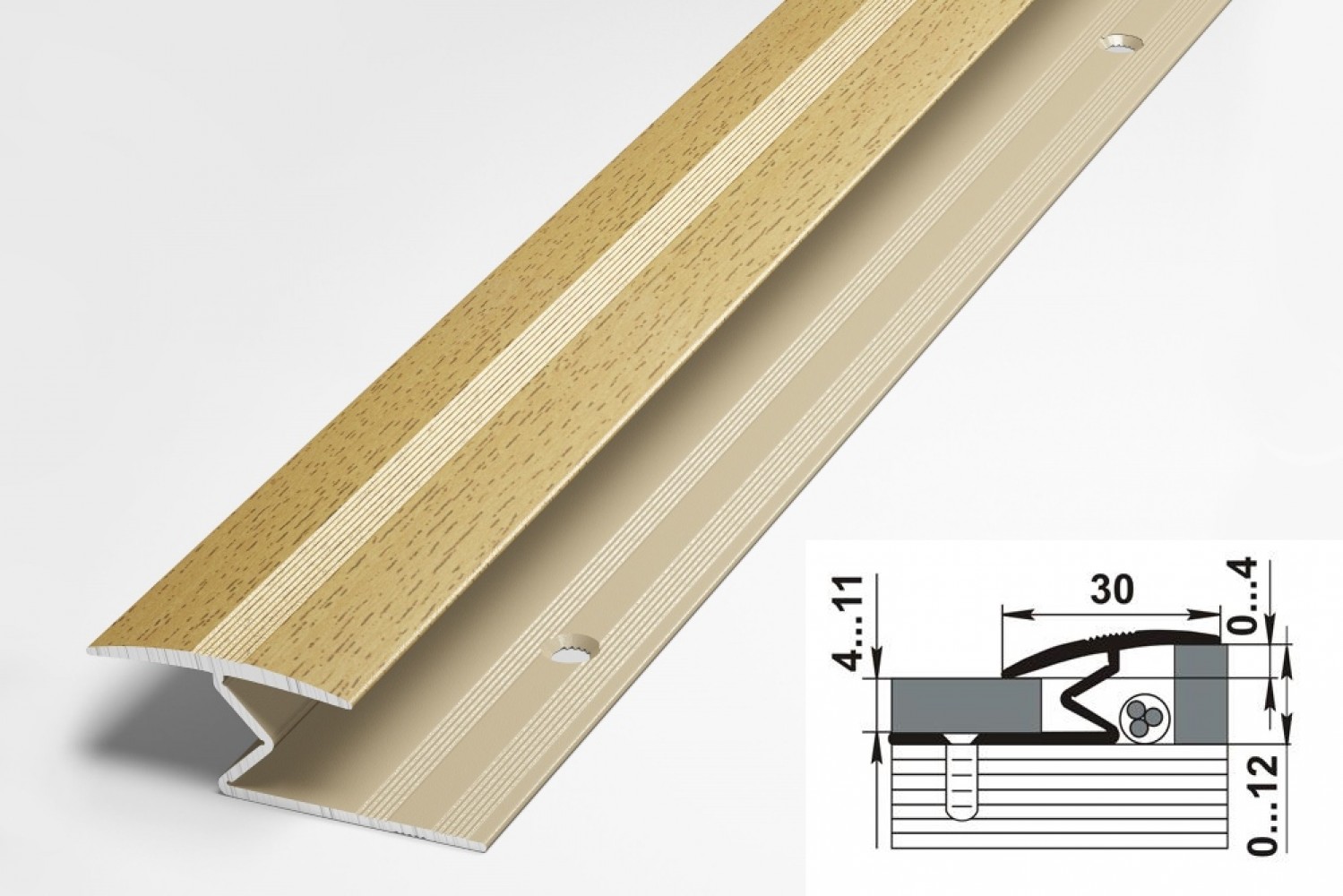
Порог-стык 30мм “DO-4” 0,9м Ясень (41) ламинир. алюм.
алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Ясень
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Ясень (41) ламинир. алюм.
алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 2,7м Тик (45) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
-
Цвет:
Тик
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
2700
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 2,7м Тик (45) ламинир. алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Венге (30) ламинир. алюм.
алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
-
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Венге
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Венге (30) ламинир. алюм.
алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Вишня темн. (35) ламинир. алюм.
-
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Вишня темная
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Вишня темн. (35) ламинир. алюм.
Перейти в карточку товараВ корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товара В наличииПредзаказ
Порог-стык 30мм “DO-4” 0,9м Вяз (42) ламинир. алюм.
алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Вяз
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Вяз (42) ламинир. алюм.
алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб (28) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб (28) ламинир. алюм.
Перейти в карточку товараВ корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб белый (32) ламинир. алюм.
алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб белый
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб белый (32) ламинир.-800x800.jpg) алюм.
алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб графитовый (47) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб графитовый
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб графитовый (47) ламинир. алюм.
Перейти в карточку товараВ корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб дымчатый (46) ламинир.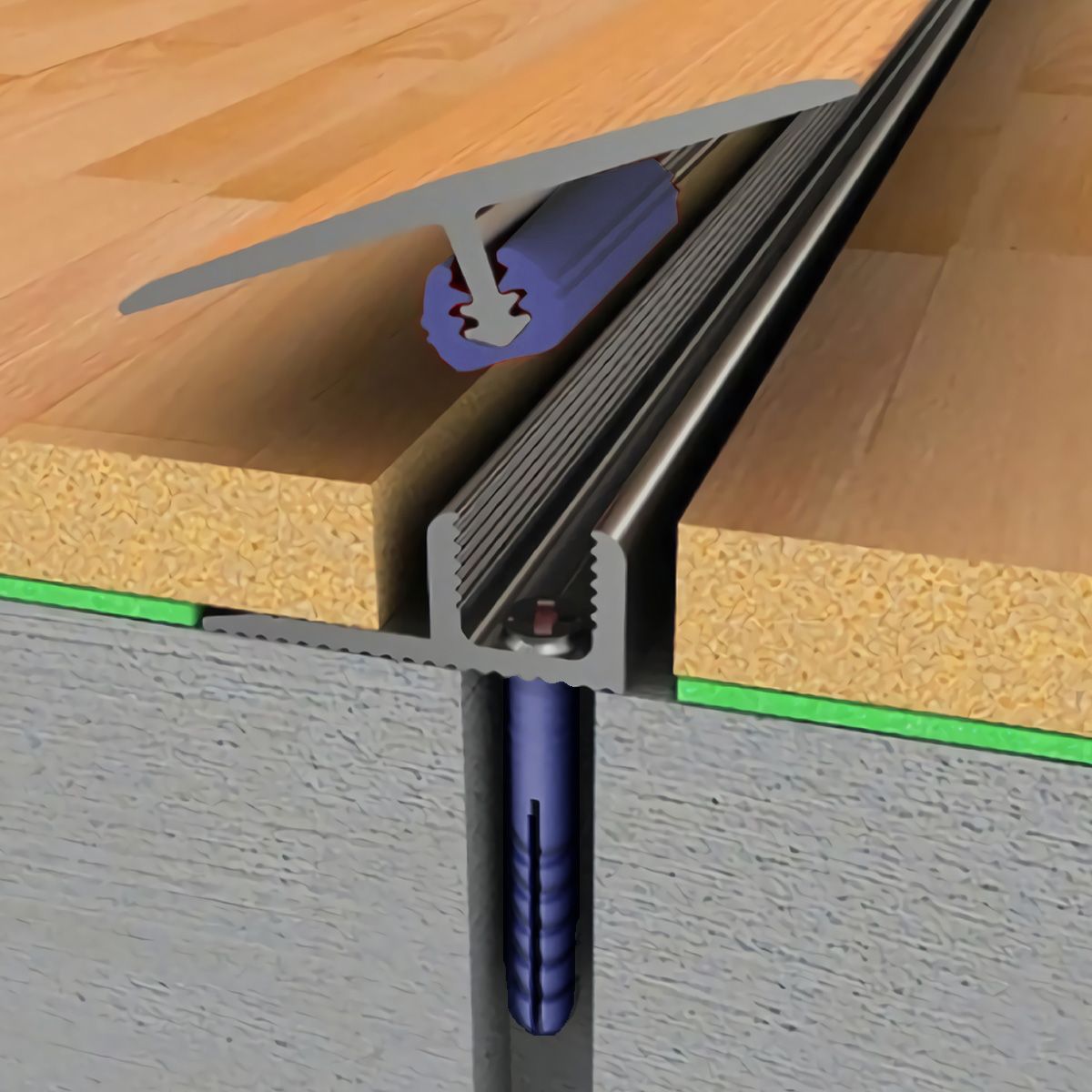 алюм.
алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб дымчатый
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб дымчатый (46) ламинир. алюм.
алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб корейский (44) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб корейский
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб корейский (44) ламинир. алюм.
Перейти в карточку товараВ корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Дуб темн. (27) ламинир. алюм.
(27) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Дуб темный
Высота, мм:
4.5
Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Дуб темн. (27) ламинир. алюм.
(27) ламинир. алюм.
В корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараВ наличии
Предзаказ
Порог-стык 30мм “DO-4” 0,9м Клен (38) ламинир. алюм.
Форма профиля:
Порог одноуровневый
Материал:
Алюминий
Отделка:
Ламинированный
Назначение:
Порог для перекрытия одноуровневых стыков
Цвет:
Клен
Высота, мм:
4.
 5
5Ширина, мм:
30
Длина, мм:
900
Страна:
Россия
Тип крепления:
Скрытое крепление
Нет в наличии
Порог-стык 30мм “DO-4” 0,9м Клен (38) ламинир. алюм.
Перейти в карточку товараВ корзине шт Перейти
ПодробнееВыбрать
Перейти в карточку товараОбратный звонок
Запрос успешно отправлен!
Телефон *
Настоящим подтверждаю, что я ознакомлен и согласен с условиями оферты и политики конфиденциальности *
Предзаказ
Предзаказ успешно отправлен!
Телефон *
Настоящим подтверждаю, что я ознакомлен и согласен с условиями оферты и политики конфиденциальности *
Добавить в корзину
Перейти в корзину
Заказ в один клик
Контактное лицо (ФИО):
Контактный телефон:
Адрес:
Email:
Согласие на обработку персональных данных
Настоящим подтверждаю, что я ознакомлен и согласен с условиями оферты и политики конфиденциальности.
Комментарий:
Как правильно выбрать стыковочный порог?
Как правильно выбрать стыковочный порог? Амурская область Изменить регион
Ваш регион Амурская область?
ДаВыбрать другой регион
Телефон для связи
8-812-33-22-756
Написать нам Заказать звонокг. Благовещенск,
ул. Пионерская, д. 154
Главная
Блог
Как правильно выбрать стыковочный порог?
Подобрать и оформить пол качественными отделочными напольными материалами, это половина дела, важно еще с учетом требований подобрать элементы для оформления стыков и межкомнатные пороги. Преимущества применения стыковочного порога:
Преимущества применения стыковочного порога:
1. Компенсирующая функция. Отметим, что вне зависимости от типа напольного покрытия его укладка предусматривает наличие небольшого компенсационного зазора. Для того, чтобы отделка выглядела аккуратно рекомендуется применять специальные стыковочные пороги, которые предлагаются:
- Выравнивающие (разноуровневые) используется с целью выравнивания уровня пола между комнатами в дверном проеме;
- Расширительные (перекрывающий, прямой, стыковочный) устанавливаются в дверном проеме между помещениями с одинаковым уровнем пола.
2. Декоративная функция. Отметим, что, к примеру, в гостиной и на кухне будет использоваться разное напольное покрытие, стыковочный порожек делает переход между ними более аккуратным, прячет наличие стыка.
Если вы обратитесь к нам, то сможете недорого купить стыковочные пороги максимального качества, которые выгодно отличаются надежностью, простотой, удобством монтажа и обслуживания, долговечностью эксплуатации.
Итак, сразу отметим, что порог должен не только быть красивым, но и соответствовать по оформлению общему стилю помещений. При выборе необходимо обратить внимание на качество и прочностные характеристики, цветовой оттенок, но наибольшее внимание нужно отвести рассмотрению используемых при изготовлении материалов. Сегодня в ассортименте представлены изделия из:
- Натурального дерева, такая продукция отличается экологической безопасностью, подойдет для использования в любых помещениях с нормальным уровнем влажности. Пороги из дерева в процессе эксплуатации требуют к себе дополнительного внимания, их главный недостаток высокая стоимость;
- Металлические пороги выгодно отличаются и выделяются максимальной прочностью и надежностью. Они отлично смотрятся в современном стиле, но отметим, что для помещений с высоким уровнем влажности не подойдут.
- Пластиковые пороги – это отличный вариант, отличается хорошим сочетанием цена/качества. Такие пороги представлены в большом ассортименте цветовых решений.
 Могут применяться для установки в помещения жилого направления, а также в ванную, туалет. Следует отметить простоту и удобство монтажа, что обеспечивается пластичностью.
Могут применяться для установки в помещения жилого направления, а также в ванную, туалет. Следует отметить простоту и удобство монтажа, что обеспечивается пластичностью. - Ламинированные пороги при производстве покрываются специальной пленкой, наличие которой придает готовой продукции надежную защиту от воздействия влаги. Изделия представлены в ассортименте цветов, размеров, что позволит легко подобрать вариант, максимально удовлетворяющий современным требованиям.
В каталоге на сайте нашей компании предлагается продукция на любой вкус, сотрудничая с нами, вы получите профессиональные консультации и возможность с максимальной для себя выгодой купить качественный и долговечный в использовании товар.
Molecular Docking: Мощный подход к открытию лекарств на основе структуры
[1] Jorgensen WL. Многочисленные роли вычислений в открытии лекарств. Наука. 2004;303(5665):1813–1818. [PubMed] [Google Scholar]
Наука. 2004;303(5665):1813–1818. [PubMed] [Google Scholar]
[2] Баджорат Дж. Интеграция виртуального и высокопроизводительного скрининга. Nat Rev Drug Discov. 2002;1(11):882–894. [PubMed] [Google Scholar]
[3] Walters WP, Stahl MT, Murcko MA. Виртуальный скрининг – обзор. Препарат Дисков. Сегодня. 1998; 3: 160–178. [Академия Google]
[4] Лангер Т., Хоффманн Р.Д. Виртуальный скрининг: эффективный инструмент для выявления структуры потенциальных клиентов? Курр Фарм Дез. 2001;7(7):509–527. [PubMed] [Google Scholar]
[5] Kitchen DB, Decornez H, Furr JR, Bajorath J. Стыковка и оценка в виртуальном скрининге для обнаружения наркотиков: методы и приложения. Nat Rev Drug Discov. 2004;3(11):935–949. [PubMed] [Google Scholar]
[6] Gohlke H, Klebe G. Подходы к описанию и прогнозированию аффинности связывания низкомолекулярных лигандов с макромолекулярными рецепторами. Angew Chem Int Ed Engl. 2002;41(15):2644–2676. [PubMed] [Академия Google]
[7] Moitessier N, Englebienne P, Lee D, Lawandi J, Corbeil CR. На пути к разработке универсальных, быстрых и высокоточных методов стыковки/скоринга: долгий путь. Бр Дж. Фармакол. 2008; 153 (Приложение 1): S7–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
На пути к разработке универсальных, быстрых и высокоточных методов стыковки/скоринга: долгий путь. Бр Дж. Фармакол. 2008; 153 (Приложение 1): S7–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[8] Shoichet BK, McGovern SL, Wei B, Irwin JJ. Хиты, лиды и артефакты виртуального и высокопроизводительного скрининга. 2002. Молекулярная информатика: противостояние сложности. [Google Scholar]
[9] Бэйли Д., Браун Д. Высокопроизводительная химия и структурный дизайн: выживает самый умный. Наркотиков Дисков Сегодня. 2001;6(2):57–59.. [PubMed] [Google Scholar]
[10] Kuntz ID, Blaney JM, Oatley SJ, Langridge R, Ferrin TE. Геометрический подход к взаимодействиям макромолекула-лиганд. Дж Мол Биол. 1982;161(2):269–288. [PubMed] [Google Scholar]
[11] Гальперин И., Ма Б., Вольфсон Х., Нуссинов Р. Принципы стыковки: обзор алгоритмов поиска и руководство по скоринговым функциям. Белки. 2002;47(4):409–443. [PubMed] [Google Scholar]
[12] Coupez B, Lewis RA. Стыковка и подсчет очков — теоретически легко, практически невозможно? Курр Мед Хим. 2006;13(25):2995–3003. [PubMed] [Google Scholar]
2006;13(25):2995–3003. [PubMed] [Google Scholar]
[13] Контойанни М., Мадхав П., Суханек Э., Сейбел В. Теоретические и практические аспекты виртуального скрининга: проторенное поле? Курр Мед Хим. 2008;15(2):107–116. [PubMed] [Google Scholar]
[14] Brooijmans N, Kuntz ID. Алгоритмы молекулярного распознавания и докинга. Annu Rev Biophys Biomol Struct. 2003; 32: 335–373. [PubMed] [Google Scholar]
[15] тен Бринк Т., Экснер Т.Э. Влияние протонирования, таутомерных и стереоизомерных состояний на результаты докинга белок-лиганд. Модель J Chem Inf. 2009 г.;49(6):1535–1546. [PubMed] [Google Scholar]
[16] Cross JB, Thompson DC, Rai BK, Baber JC, Fan KY, Hu Y, Humblet C. Сравнение нескольких программ молекулярной стыковки: предсказание позы и точность виртуального скрининга. Модель J Chem Inf. 2009;49(6):1455–1474. [PubMed] [Google Scholar]
[17] Li X, Li Y, Cheng T, Liu Z, Wang R. Оценка эффективности четырех программ молекулярной стыковки на разнообразном наборе белково-лигандных комплексов. J Comput Chem. 2010;31(11):2109–2125. [PubMed] [Академия Google]
J Comput Chem. 2010;31(11):2109–2125. [PubMed] [Академия Google]
[18] Plewczynski D, Lazniewski M, Augustyniak R, Ginalski K. Можно ли доверять результатам докинга? Оценка семи часто используемых программ в базе данных PDBbind. J Comput Chem. 2010 doi: 10.1002/jcc.21643 [PubMed] [Google Scholar]
[19] McConkey BJ, Sobolev V, Edelman M. Эффективность современных методов стыковки лиганд-белок. Современная наука. 2002; 83: 845–855. [Google Scholar]
[20] Гудфорд П.Дж. Вычислительная процедура для определения энергетически выгодных мест связывания на биологически важных макромолекулах. J Med Chem. 1985;28(7):849–857. [PubMed] [Google Scholar]
[21] Kastenholz MA, Pastor M, Cruciani G, Haaksma EE, Fox T. GRID/CPCA: новый вычислительный инструмент для разработки селективных лигандов. J Med Chem. 2000;43(16):3033–3044. [PubMed] [Google Scholar]
[22] Левитт Д.Г., Банашак Л.Дж. POCKET: метод компьютерной графики для идентификации и отображения белковых полостей и окружающих их аминокислот. Дж Мол График. 1992;10(4):229–234. [PubMed] [Google Scholar]
Дж Мол График. 1992;10(4):229–234. [PubMed] [Google Scholar]
[23] Ласковски Р.А. SURFNET: программа для визуализации молекулярных поверхностей, полостей и межмолекулярных взаимодействий. Дж Мол График. 1995;13(5):323–330. 307–328. [PubMed] [Google Scholar]
[24] Glaser F, Morris RJ, Najmanovich RJ, Laskowski RA, Thornton JM. Метод локализации карманов связывания лигандов в белковых структурах. Белки. 2006;62(2):479–488. [PubMed] [Google Scholar]
[25] Brady GP, Jr., Stouten PF. Быстрое прогнозирование и визуализация карманов связывания белка с помощью PASS. J Comput Aided Mol Des. 2000;14(4):383–401. [PubMed] [Google Scholar]
[26] Мезей М. Новый метод картирования макромолекулярной топографии. Графовая модель J-Mol. 2003;21(5):463–472. [PubMed] [Академия Google]
[27] Fischer E. Einfluss der configuration auf die wirkung derenzyme. Бер. Дт. хим. Гэс. 1894; 27: 2985–2993. [Google Scholar]
[28] Кошланд Д.Е., младший. Корреляция структуры и функции в ферментном действии. Наука. 1963; 142: 1533–1541. [PubMed] [Google Scholar]
Наука. 1963; 142: 1533–1541. [PubMed] [Google Scholar]
[29] Hammes GG. Множественные конформационные изменения при ферментативном катализе. Биохимия. 2002;41(26):8221–8228. [PubMed] [Google Scholar]
[30] Рари М., Крамер Б., Ленгауэр Т., Клебе Г. Быстрый гибкий метод стыковки с использованием алгоритма пошагового построения. Дж Мол Биол. 1996;261(3):470–489. [PubMed] [Google Scholar]
[31] Morris GM, Goodsell DS, Halliday RS, Huey R, Hart WE, Belew RK, Olson AJ. Автоматическая стыковка с использованием генетического алгоритма Ламарка и эмпирической функции свободной энергии связывания. Журнал вычислительной химии. 1998;19(14):1639–1662. [Google Scholar]
[32] Джонс Дж., Уиллетт П., Глен Р.С., Лич А.Р., Тейлор Р. Разработка и проверка генетического алгоритма гибкой стыковки. Дж Мол Биол. 1997;267(3):727–748. [PubMed] [Академия Google]
[33] Фриснер Р.А., Бэнкс Дж.Л., Мерфи Р.Б., Халгрен Т.А., Кличич Дж.Дж., Майнц Д.Т., Репаски М.П., Нолл Э.Х., Шелли М. , Перри Дж.К., Шоу Д.Е., Фрэнсис П., Шенкин П.С. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1 Способ и оценка точности стыковки. J Med Chem. 2004;47(7):1739–1749. [PubMed] [Google Scholar]
, Перри Дж.К., Шоу Д.Е., Фрэнсис П., Шенкин П.С. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1 Способ и оценка точности стыковки. J Med Chem. 2004;47(7):1739–1749. [PubMed] [Google Scholar]
[34] McGann MR, Almond HR, Nicholls A, Grant JA, Brown FK. Гауссовы функции стыковки. Биополимеры. 2003;68(1):76–90. [PubMed] [Google Scholar]
[35] Perola E, Walters WP, Charifson PS. Подробное сравнение текущих методов стыковки и оценки систем, имеющих значение для фармацевтики. Белки. 2004; 56(2):235–249.. [PubMed] [Google Scholar]
[36] Шерман В., Дэй Т., Джейкобсон М.П., Фриснер Р.А., Фарид Р. Новая процедура моделирования эффектов подгонки, индуцированных лигандом/рецептором. J Med Chem. 2006;49(2):534–553. [PubMed] [Google Scholar]
[37] Jiang F, Kim SH. «Мягкий докинг»: сопоставление кубов молекулярных поверхностей. Дж Мол Биол. 1991;219(1):79–102. [PubMed] [Google Scholar]
[38] Claussen H, Buning C, Rarey M, Lengauer T. FlexE: эффективный молекулярный докинг с учетом вариаций структуры белка. Дж Мол Биол. 2001; 308(2):377–39.5. [PubMed] [Google Scholar]
Дж Мол Биол. 2001; 308(2):377–39.5. [PubMed] [Google Scholar]
[39] Alonso H, Bliznyuk AA, Gready JE. Сочетание стыковки и молекулярно-динамического моделирования при разработке лекарств. Med Res Rev. 2006;26(5):531–568. [PubMed] [Google Scholar]
[40] Sander T, Liljefors T, Balle T. Прогнозирование конформации рецептора для связывания агониста iGluR2: стыковка QM/MM с обширным конформационным ансамблем, созданным с использованием анализа в нормальном режиме. Графовая модель J-Mol. 2008;26(8):1259–1268. [PubMed] [Google Scholar]
[41] Subramanian J, Sharma S, C BR. Новый компьютерный анализ индуцированных лигандом конформационных изменений в сайтах связывания АТФ циклинзависимых киназ. J Med Chem. 2006;49(18): 5434–5441. [PubMed] [Google Scholar]
[42] Subramanian J, Sharma S, C BR. Моделирование и выбор гибких белков для разработки лекарств на основе структуры: движение основной и боковой цепи в p38 MAPK. ХимМедХим. 2008;3(2):336–344. [PubMed] [Google Scholar]
[43] Бринт А. Т., Уиллетт П. Алгоритмы идентификации трехмерных максимальных общих подструктур. Дж. Хим. Инф. вычисл. науч. 1987; 27: 152–158. [Google Scholar]
Т., Уиллетт П. Алгоритмы идентификации трехмерных максимальных общих подструктур. Дж. Хим. Инф. вычисл. науч. 1987; 27: 152–158. [Google Scholar]
[44] Фишер Д., Норел Р., Вольфсон Х., Нусинов Р. Поверхностные мотивы с помощью метода компьютерного зрения: поиск, обнаружение и последствия для распознавания белок-лиганд. Белки. 1993;16(3):278–292. [PubMed] [Google Scholar]
[45] Норел Р., Фишер Д., Вольфсон Х.Дж., Нуссинов Р. Распознавание молекулярной поверхности с помощью метода компьютерного зрения. Белок англ. 1994;7(1):39–46. [PubMed] [Google Scholar]
[46] Miller MD, Kearsley SK, Underwood DJ, Sheridan RP. FLOG: система для выбора «квазигибких» лигандов, комплементарных рецептору известной трехмерной структуры. J Comput Aided Mol Des. 1994;8(2):153–174. [PubMed] [Google Scholar]
[47] Diller DJ, Merz KM., Jr. Высокопроизводительная стыковка для проектирования библиотек и определения приоритетов библиотек. Белки. 2001;43(2):113–124. [PubMed] [Академия Google]
[48] Буркхард П. , Тейлор П., Уолкиншоу, доктор медицины. Пример белкового лиганда, найденного в результате анализа базы данных: описание метода докинга и его проверка с помощью рентгенограммы 2,3 А структуры комплекса тромбин-лиганд. Дж Мол Биол. 1998;277(2):449–466. [PubMed] [Google Scholar]
, Тейлор П., Уолкиншоу, доктор медицины. Пример белкового лиганда, найденного в результате анализа базы данных: описание метода докинга и его проверка с помощью рентгенограммы 2,3 А структуры комплекса тромбин-лиганд. Дж Мол Биол. 1998;277(2):449–466. [PubMed] [Google Scholar]
[49] DesJarlais RL, Sheridan RP, Dixon JS, Kuntz ID, Venkataraghavan R. Стыковка гибких лигандов с макромолекулярными рецепторами по молекулярной форме. J Med Chem. 1986;29(11):2149–2153. [PubMed] [Академия Google]
[50] Кунц И.Д., Лич А.Р. Конформационный анализ гибких лигандов в сайтах макромолекулярных рецепторов. Дж. Вычисл. хим. 1992; 13: 730–748. [Google Scholar]
[51] Ewing TJ, Makino S, Skillman AG, Kuntz ID. DOCK 4.0: стратегии поиска для автоматизированной молекулярной стыковки гибких баз данных молекул. J Comput Aided Mol Des. 2001;15(5):411–428. [PubMed] [Google Scholar]
[52] Welch W, Ruppert J, Jain AN. Hammerhead: быстрая, полностью автоматизированная стыковка гибких лигандов с сайтами связывания белков. хим. биол. 1996;3(6):449–462. [PubMed] [Google Scholar]
хим. биол. 1996;3(6):449–462. [PubMed] [Google Scholar]
[53] Schnecke V, Kuhn LA. Виртуальный скрининг с сольватацией и лиганд-индуцированной комплементарностью. Перспективы открытия и разработки лекарств. 2000;20:171–190. [Google Scholar]
[54] Жолдос З., Рейд Д., Саймон А., Садджад Б.С., Джонсон А.П. eHiTS: инновационный подход к проблемам функции стыковки и подсчета очков. Curr Protein Pept Sci. 2006;7(5):421–435. [PubMed] [Google Scholar]
[55] Миранкер А., Карплюс М. Функциональные карты сайтов связывания: метод одновременного поиска нескольких копий. Белки. 1991;11(1):29–34. [PubMed] [Google Scholar]
[56] Eisen MB, Wiley DC, Karplus M, Hubbard RE. HOOK: программа для поиска новой молекулярной архитектуры, которая удовлетворяет химическим и стерическим требованиям сайта связывания макромолекулы. Белки. 1994;19(3):199–221. [PubMed] [Google Scholar]
[57] Bohm HJ. LUDI: основанный на правилах автоматический дизайн новых заместителей для ингибиторов ферментов. J Comput Aided Mol Des. 1992;6(6):593–606. [PubMed] [Google Scholar]
J Comput Aided Mol Des. 1992;6(6):593–606. [PubMed] [Google Scholar]
[58] Goodsell DS, Lauble H, Stout CD, Olson AJ. Автоматизированный докинг в кристаллографии: анализ субстратов аконитазы. Белки. 1993;17(1):1–10. [PubMed] [Google Scholar]
[59] Hart TN, Read RJ. Метод многозаходной стыковки Монте-Карло. Белки. 1992;13(3):206–222. [PubMed] [Google Scholar]
[60] Goodsell DS, Olson AJ. Автоматическая стыковка подложек с белками путем имитации отжига. Белки. 1990;8(3):195–202. [PubMed] [Google Scholar]
[61] Абагян Р., Тотров М., Кузнецов Д. ICM-Новый метод моделирования и дизайна белков: приложения для стыковки и прогнозирования структуры на основе искаженной нативной конформации. Дж. Вычисл. хим. 1994;15:488–506. [Google Scholar]
[62] McMartin C, Bohacek RS. QXP: мощные, быстрые компьютерные алгоритмы для разработки лекарств на основе структуры. J Comput Aided Mol Des. 1997;11(4):333–344. [PubMed] [Google Scholar]
[63]
Accelrys Inc., Сан-Диего, Калифорния, США.
[64] Оширо К.М., Кунц И.Д., Диксон Дж.С. Гибкая стыковка лигандов с использованием генетического алгоритма. J Comput Aided Mol Des. 1995;9(2):113–130. [PubMed] [Google Scholar]
[65] Verdonk ML, Cole JC, Hartshorn MJ, Murray CW, Taylor RD. Улучшенная стыковка белок-лиганд с использованием GOLD. Белки. 2003;52(4):609–623. [PubMed] [Google Scholar]
[66] Кларк К.П. Ajay, Гибкая стыковка лигандов без регулировки параметров в четырех комплексах лиганд-рецептор. J Comput Chem. 1995; 16:1210–1226. [Google Scholar]
[67] Taylor JS, Burnett RM. DARWIN: программа для стыковки гибких молекул. Белки. 2000;41(2):173–191. [PubMed] [Google Scholar]
[68] Cornell WD, Cieplak P, Bayly CI, Gould IR, Merz KM, Ferguson DM, Spellmeyer DC, Fox T, Caldwell JW, Kollman PA. Силовое поле второго поколения для моделирования белков, нуклеиновых кислот и органических молекул. Варенье. хим. соц. 1995;117:5179–5197. [Google Scholar]
[69] Weiner SJ, Kollman PA, Case DA, Singh UC, Ghio C, Alagona G, Profeta S, Jr. , Weiner P. Новое силовое поле для молекулярно-механического моделирования нуклеиновых кислот и белков. Варенье. хим. соц. 1984; 106: 765–784. [Google Scholar]
, Weiner P. Новое силовое поле для молекулярно-механического моделирования нуклеиновых кислот и белков. Варенье. хим. соц. 1984; 106: 765–784. [Google Scholar]
[70] Брукс Б.Р., Брукколери Р.Е., Олафсон Б.Д., Стейтс Д.Дж., Сваминатан С., Карплюс М. CHARMM: программа для расчета макромолекулярной энергии, минимизации и динамики. Дж. Вычисл. хим. 1983; 4: 187–217. [Академия Google]
[71] Коллман П.А. Расчеты свободной энергии: приложения к химическим и биохимическим явлениям. хим. 1993; 93: 2395–2417. [Google Scholar]
[72] Аквист Дж., Лужков В.Б., Брандсдал Б.О. Аффинность связывания лиганда из моделирования МД. Acc Chem Res. 2002;35(6):358–365. [PubMed] [Google Scholar]
[73] Carlson HA, Jorgensen WL. Метод расширенного линейного отклика для определения свободных энергий гидратации. J Phys Chem. 1995;99:10667–10673. [Google Scholar]
[74] Шойхет Б.К., Страуд Р.М., Санти Д.В., Кунц И.Д., Перри К.М. Основанное на структуре открытие ингибиторов тимидилатсинтазы. Наука. 1993;259(5100):1445–1450. [PubMed] [Google Scholar]
Наука. 1993;259(5100):1445–1450. [PubMed] [Google Scholar]
[75] Мишель Дж., Вердонк М.Л., Эссекс Дж.В. Прогнозирование сродства связывания белок-лиганд с помощью имплицитного моделирования растворителя: инструмент для оптимизации свинца? J Med Chem. 2006;49(25):7427–7439. [PubMed] [Google Scholar]
[76] Briggs JM, Marrone TJ, McCammon JA. Новые горизонты вычислительной науки и актуальность для фармацевтического дизайна. Тенденции Кардиовасц. Мед. 1996; 6: 198–206. [PubMed] [Google Scholar]
[77] Bohm HJ. Прогнозирование констант связывания белковых лигандов: быстрый метод приоритизации совпадений, полученных в результате проектирования de novo или программ поиска в базе данных 3D. J Comput Aided Mol Des. 1998;12(4):309–323. [PubMed] [Google Scholar]
[78] Гельхаар Д.К., Верховкер Г.М., Рейто П.А., Шерман С.Дж., Фогель Д.Б., Фогель Л.Дж., Фрир С.Т. Молекулярное распознавание ингибитора AG-1343 протеазой ВИЧ-1: конформационно гибкая стыковка путем эволюционного программирования. хим. биол. 1995;2(5):317–324. [PubMed] [Google Scholar]
хим. биол. 1995;2(5):317–324. [PubMed] [Google Scholar]
[79] Верховкер Г.М., Бузида Д., Гельхаар Д.К., Рейто П.А., Артурс С., Колсон А.Б., Фрир С.Т., Ларсон В., Люти Б.А., Марроне Т., Роуз П.В. Расшифровка распространенных сбоев при молекулярном докинге лиганд-белковых комплексов. J Comput Aided Mol Des. 2000;14(8):731–751. [PubMed] [Академия Google]
[80] Джейн А.Н. Подсчет нековалентных взаимодействий белок-лиганд: непрерывная дифференцируемая функция, настроенная для вычисления аффинности связывания. J Comput Aided Mol Des. 1996;10(5):427–440. [PubMed] [Google Scholar]
[81] Head RD, Smythe ML, Oprea TI, Waller CL, Green SM, Marshall GR. ПРОВЕРКА: новый метод предсказания связывания новых лигандов на основе рецепторов. Варенье. хим. соц. 1996; 118:3959–3969. [Google Scholar]
[82] Gehlhaar DK, Moerder KE, Zichi D, Sherman CJ, Ogden RC, Freer ST. Дизайн ингибиторов ферментов de novo путем генерации лигандов Монте-Карло. J Med Chem. 1995;38(3):466–472. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[83] Элдридж, М.Д., Мюррей К.В., Аутон Т.Р., Паолини Г.В., Ми Р.П. Эмпирические оценочные функции: I. Разработка быстрой эмпирической оценочной функции для оценки аффинности связывания лигандов в рецепторных комплексах. J Comput Aided Mol Des. 1997;11(5):425–445. [PubMed] [Google Scholar]
[84] Muegge I, Martin YC. Общая и быстрая функция оценки взаимодействий белок-лиганд: упрощенный потенциальный подход. J Med Chem. 1999;42(5):791–804. [PubMed] [Google Scholar]
[85] Mitchell JBO, Laskowski RA, Alex A, Thornton JM. Пип-потенциал средней силы, описывающий белок-лигандные взаимодействия: I. генерирующий потенциал. Дж. Вычисл. хим. 1999;20(11):1165–1176. [Google Scholar]
[86] Ищенко А.В., Шахнович Е.И. SMall Molecule Growth 2001 (SMoG2001): улучшенная функция оценки взаимодействия белок-лиганд, основанная на знаниях. J Med Chem. 2002;45(13):2770–2780. [PubMed] [Google Scholar]
[87] Feher M, Deretey E, Roy S. BHB: простая функция оценки, основанная на знаниях, для повышения эффективности проверки базы данных. J Chem Inf Comput Sci. 2003;43(4):1316–1327. [PubMed] [Академия Google]
J Chem Inf Comput Sci. 2003;43(4):1316–1327. [PubMed] [Академия Google]
[88] Верховкер Г., Аппельт К., Фрир С.Т., Виллафранка Ю.Е. Эмпирические расчеты свободной энергии лиганд-белковых кристаллографических комплексов. I. Основанные на знаниях потенциалы взаимодействия лиганд-белок, применяемые для предсказания аффинности связывания протеазы вируса иммунодефицита человека 1. Белок англ. 1995;8(7):677–691. [PubMed] [Google Scholar]
[89] Wallqvist A, Jernigan RL, Covell DG. Параметризация свободной энергии связывания фермента с ингибитором на основе предпочтений. Приложения к дизайну ингибитора протеазы ВИЧ-1. Белковая наука. 1995;4(9):1881–1903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[90] Gohlke H, Hendlich M, Klebe G. Функция оценки, основанная на знаниях, для прогнозирования взаимодействий белок-лиганд. Дж Мол Биол. 2000;295(2):337–356. [PubMed] [Google Scholar]
[91] ДеВитте Р.С., Шахнович Э.И. SMoG: метод проектирования de Novo, основанный на простых, быстрых и точных оценках свободной энергии. 1 Методология и подтверждающие данные. Варенье. хим. соц. 1996; 118:11733–11744. [Google Scholar]
1 Методология и подтверждающие данные. Варенье. хим. соц. 1996; 118:11733–11744. [Google Scholar]
[92] Чарифсон П.С., Коркери Дж.Дж., Мурко М.А., Уолтерс В.П. Консенсусная оценка: метод повышения частоты попаданий из баз данных стыковки трехмерных структур с белками. J Med Chem. 1999;42(25):5100–5109. [PubMed] [Google Scholar]
[93] Feher M. Согласованная оценка взаимодействий белок-лиганд. Наркотиков Дисков Сегодня. 2006;11(9-10):421–428. [PubMed] [Google Scholar]
[94] Кларк Р.Д., Стрижев А., Леонард Дж.М., Блейк Дж.Ф., Мэтью Дж.Б. Согласованная оценка взаимодействий лиганд/белок. Графовая модель J-Mol. 2002;20(4):281–295. [PubMed] [Google Scholar]
[95] Сринивасан Дж., Читам Т.Е., Чиплак П., Коллман П.А., Кейс Д.А. Исследования стабильности спиралей ДНК, РНК и фосфорамидат-ДНК с помощью растворителя. Журнал Американского химического общества. 1998;120(37):9401–9409. [Google Scholar]
[96] Коллман П.А., Массова И., Рейес С., Кун Б., Хуо С., Чонг Л. , Ли М., Ли Т., Дуан И., Ван В., Донини О., Чеплак П., Шринивасан Дж., Кейс Д.А. , Cheatham TE., 3rd Расчет структур и свободных энергий сложных молекул: сочетание молекулярной механики и моделей сплошных сред. Acc Chem Res. 2000;33(12):889–897. [PubMed] [Google Scholar]
, Ли М., Ли Т., Дуан И., Ван В., Донини О., Чеплак П., Шринивасан Дж., Кейс Д.А. , Cheatham TE., 3rd Расчет структур и свободных энергий сложных молекул: сочетание молекулярной механики и моделей сплошных сред. Acc Chem Res. 2000;33(12):889–897. [PubMed] [Google Scholar]
[97] Still WC, Tempczyk A, Hawley RC, Hendrickson T. Semianalytical Treatment of Solvation for Molecular Mechanics and Dynamics. Варенье. хим. соц. 1990;112(16):6127–6129. [Google Scholar]
[98] Гимарайнш Ч.Р., Матиовец А.М. Устранение ограничений с помощью процедуры оценки MM-GB/SA с использованием метода WaterMap и расчетов возмущения свободной энергии. Модель J Chem Inf. 50 (4): 547–559. [PubMed] [Google Scholar]
[99] Сингх Н., Уоршел А. Расчеты абсолютной свободной энергии связывания: точность вычислительной оценки взаимодействий белок-лиганд. Белки. 2010;78(7):1705–1723. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[100] Гэбб Х.А., Джексон Р.М., Штернберг М.Дж. Моделирование стыковки белков с использованием комплементарности формы, электростатики и биохимической информации. Дж Мол Биол. 1997;272(1):106–120. [PubMed] [Google Scholar]
Дж Мол Биол. 1997;272(1):106–120. [PubMed] [Google Scholar]
[101] Брон С., Кербош Дж. Алгоритм 457: поиск всех клик неориентированного графа. Коммуникации АКМ. 1973;16(9):575–576. [Google Scholar]
[102] Meng EC, Shoichet BK, Kuntz ID. Автоматическая стыковка с оценкой энергии на основе сети. Дж. Вычисл. хим. 1992; 13: 505–524. [Академия Google]
[103] Zou XQ, Sun Y, Kuntz ID. Включение сольватации в расчеты свободной энергии связывания лиганда с использованием обобщенной модели Борна. Варенье. хим. соц. 1999; 121:8033–8043. [Google Scholar]
[104] Тротт О., Олсон А.Дж. AutoDock Vina: повышение скорости и точности стыковки с помощью новой функции подсчета очков, эффективной оптимизации и многопоточности. J Comput Chem. 2009 [бесплатная статья PMC] [PubMed] [Google Scholar]
[105] Bohm HJ. Разработка простой эмпирической оценочной функции для оценки константы связывания комплекса белок-лиганд с известной трехмерной структурой. J Comput Aided Mol Des. 1994;8(3):243–256. [PubMed] [Google Scholar]
1994;8(3):243–256. [PubMed] [Google Scholar]
[106] Тиг С.Дж. Значение гибкости белков для открытия лекарств. Nat Rev Drug Discov. 2003;2(7):527–541. [PubMed] [Google Scholar]
[107] Gschwend DA, Good AC, Kuntz ID. Молекулярная стыковка на пути к открытию лекарств. Дж Мол Признать. 1996;9(2):175–186. [PubMed] [Google Scholar]
[108] Тотров М., Абагян Р. Стыковка белок-лиганд как проблема оптимизации энергии. В: Раффа РБ, редактор. Термодинамика лекарственного рецептора: введение и экспериментальные применения. Джон Уайли и сыновья; Нью-Йорк: 2001. стр. 603–624. [Академия Google]
[109] Лич АР. Стыковка лиганда с белками с дискретной гибкостью боковой цепи. Дж Мол Биол. 1994; 235(1):345–356. [PubMed] [Google Scholar]
[110] Desmet J, De Maeyer M, Hazes B, Lasters I. Теорема об исключении тупика и ее использование для позиционирования боковой цепи белка. Природа. 1992; 356: 539–542. [PubMed] [Google Scholar]
[111] Абагян Р., Тотров М. Вероятностный конформационный поиск методом Монте-Карло и электростатические расчеты для пептидов и белков. Дж Мол Биол. 1994;235(3):983–1002. [PubMed] [Google Scholar]
Дж Мол Биол. 1994;235(3):983–1002. [PubMed] [Google Scholar]
[112] Morris GM, Huey R, Lindstrom W, Sanner MF, Belew RK, Goodsell DS, Olson AJ. AutoDock4 и AutoDockTools4: автоматическая стыковка с избирательной гибкостью рецепторов. J Comput Chem. 2009;30(16):2785–2791. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[113] Knegtel RM, Kuntz ID, Oshiro CM. Молекулярный докинг к ансамблям белковых структур. Дж Мол Биол. 1997;266(2):424–440. [PubMed] [Google Scholar]
[114] Карлсон Х.А., Масукава К.М., Рубинс К., Бушман Ф.Д., Йоргенсен В.Л., Линс Р.Д., Бриггс Дж.М., Маккаммон Дж.А. Разработка динамической модели фармакофора для интегразы ВИЧ-1. J Med Chem. 2000;43(11):2100–2114. [PubMed] [Академия Google]
[115] Кавасотто К.Н., Абагян Р.А. Гибкость белков в стыковке лигандов и виртуальном скрининге на протеинкиназы. Дж Мол Биол. 2004;337(1):209–225. [PubMed] [Google Scholar]
[116] Дерремо П., Шлик Т. Открытие/закрытие петли ферментом триозофосфатизомеразой. Биофиз Дж. 1998; 74 (1): 72–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз Дж. 1998; 74 (1): 72–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[117] Zeng L, Zhou MM. Бромодомейн: домен, связывающий ацетиллизин. ФЭБС лат. 2002;513(1):124–128. [PubMed] [Академия Google]
[118] Venkitakrishnan RP, Zaborowski E, McElheny D, Benkovic SJ, Dyson HJ, Wright PE. Конформационные изменения петель активного центра дигидрофолатредуктазы во время каталитического цикла. Биохимия. 2004;43(51):16046–16055. [PubMed] [Google Scholar]
[119] Go N, Scheraga HA. Замыкание кольца и локальные конформационные деформации цепных молекул. Макромолекулы. 1970;3(2):178–187. [Google Scholar]
[120] Додд Л.Р., Бун Т.Д., Теодору Д.Н. Алгоритм согласованного вращения для атомистического моделирования методом Монте-Карло расплавов полимеров и стекол. Мол. физ. 1993;78:961–996. [Google Scholar]
[121] Хоффманн Д., Кнапп В. Укладка полипептидов с внерешеточной динамикой Монте-Карло: метод. Евро. Биофиз. Дж. 1996; 111:387–404. [Google Scholar]
[122] Ву М. Г., Дим М.В. Аналитический ребридинг Монте-Карло: применение к цис/транс-изомеризации пролинсодержащих циклических пептидов. Дж. Хим. физ. 1999; 14:6625–6632. [Google Scholar]
Г., Дим М.В. Аналитический ребридинг Монте-Карло: применение к цис/транс-изомеризации пролинсодержащих циклических пептидов. Дж. Хим. физ. 1999; 14:6625–6632. [Google Scholar]
[123] Ужин AR. Локальные деформации полимеров с непланарными жесткими внутренними координатами основной цепи. Дж. Комп. хим. 2000; 21:1132–1144. [Академия Google]
[124] Mezei M. Эффективная выборка Монте-Карло для длинных молекулярных цепей с использованием локальных перемещений, проверенная на сольватированном липидном бислое. Дж. Хим. физ. 2003; 118:3874–3879. [Google Scholar]
[125] Cui M, Mezei M, Osman R. Прогнозирование структур белковых петель с использованием подхода Монте-Карло с локальным перемещением и силового поля на основе сетки. Белок Eng Des Sel. 2008;21(12):729–735. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[126] Кубиньи Х. Компьютерные приложения в фармацевтических исследованиях и разработках. Джон Уайли; Нью-Йорк: 2006. [Google Scholar] 9.0003
[127] Кремер РТ. Дизайн лекарств на основе структуры: стыковка и оценка. Текущая наука о белках и пептидах. 2007; 8: 312–328. [PubMed] [Google Scholar]
Дизайн лекарств на основе структуры: стыковка и оценка. Текущая наука о белках и пептидах. 2007; 8: 312–328. [PubMed] [Google Scholar]
[128] Venhorst J, ter Laak AM, Commandeur JN, Funae Y, Hiroi T, Vermeulen NP. Моделирование гомологии изоформ цитохрома P450 2D (CYP2D) крысы и человека и компьютерная рационализация экспериментальных особенностей связывания лиганда. J Med Chem. 2003;46(1):74–86. [PubMed] [Google Scholar]
[129] Williams PA, Cosme J, Ward A, Angove HC, Matak Vinkovic D, Jhoti H. Кристаллическая структура человеческого цитохрома P450 2C9со связанным варфарином. Природа. 2003; 424 (6947): 464–468. [PubMed] [Google Scholar]
[130] Meng XY, Zheng QC, Zhang HX. Сравнительный анализ сайтов связывания между CYP2C38 и CYP2C39 мыши, основанный на моделировании гомологии, моделировании молекулярной динамики и исследованиях стыковки. Биохим Биофиз Акта. 2009;1794(7):1066–1072. [PubMed] [Google Scholar]
[131] Boehm HJ, Boehringer M, Bur D, Gmuender H, Huber W, Klaus W, Kostrewa D, Kuehne H, Luebbers T, Meunier-Keller N, Mueller F. Новые ингибиторы ДНК-гираза: предвзятый скрининг иглы на основе трехмерной структуры, проверка попадания биофизическими методами и трехмерная управляемая оптимизация. Многообещающая альтернатива случайному скринингу. J Med Chem. 2000;43(14):2664–2674. [PubMed] [Академия Google]
Новые ингибиторы ДНК-гираза: предвзятый скрининг иглы на основе трехмерной структуры, проверка попадания биофизическими методами и трехмерная управляемая оптимизация. Многообещающая альтернатива случайному скринингу. J Med Chem. 2000;43(14):2664–2674. [PubMed] [Академия Google]
[132] Киртон С.Б., Мюррей К.В., Вердонк М.Л., Тейлор Р.Д. Прогнозирование способов связывания лигандов в цитохромах Р450 и других гемсодержащих белках. Белки. 2005;58(4):836–844. [PubMed] [Google Scholar]
[133] Доман Т.Н., Макговерн С.Л., Уизерби Б.Дж., Кастен Т.П., Курумбайл Р., Сталлингс В.К., Коннолли Д.Т., Шойхет Б.К. Молекулярный докинг и высокопроизводительный скрининг новых ингибиторов протеинтирозинфосфатазы-1B. J Med Chem. 2002;45(11):2213–2221. [PubMed] [Академия Google]
[134] Шойхет Б.К., Лич А.Р., Кунц И.Д. Сольватация лиганда в молекулярном докинге. Белки. 1999;34(1):4–16. [PubMed] [Google Scholar]
[135] Лорбер Д.М., Шойхет Б.К. Гибкая стыковка лигандов с использованием конформационных ансамблей. Белковая наука. 1998;7(4):938–950. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Белковая наука. 1998;7(4):938–950. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[136] Freymann DM, Wenck MA, Engel JC, Feng J, Focia PJ, Eakin AE, Craig SP. Эффективная идентификация ингибиторов, нацеленных на конформацию закрытого активного центра HPRT из Trypanosoma cruzi. хим. биол. 2000;7(12):957–968. [PubMed] [Google Scholar]
[137] Su AI, Lorber DM, Weston GS, Baase WA, Matthews BW, Shoichet BK. Стыковка молекул по семействам для увеличения разнообразия совпадений на экранах базы данных: вычислительная стратегия и экспериментальная оценка. Белки. 2001;42(2):279–293. [PubMed] [Google Scholar]
[138] Gschwend DA, Kuntz ID. Новый взгляд на ориентационную выборку и минимизацию твердого тела в молекулярном докинге: оптимизация на лету и устранение вырождения. J Comput Aided Mol Des. 1996;10(2):123–132. [PubMed] [Google Scholar]
Надежно ли занимать первое место в рейтинге Molecular Docking как лучшее решение, не принимая во внимание имеющиеся структурные данные?
1. Юрьев Э., Рамсланд П.А. Последние разработки в области молекулярного докинга: обзор 2010–2011 гг. Дж. Мол. Признать. 2013;26:215–239. doi: 10.1002/jmr.2266. [PubMed] [CrossRef] [Google Scholar]
Юрьев Э., Рамсланд П.А. Последние разработки в области молекулярного докинга: обзор 2010–2011 гг. Дж. Мол. Признать. 2013;26:215–239. doi: 10.1002/jmr.2266. [PubMed] [CrossRef] [Google Scholar]
2. Келленбергер Э., Родриго Дж., Мюллер П., Рогнан Д. Сравнительная оценка восьми инструментов стыковки для точности стыковки и виртуального скрининга. Белки. 2004; 57: 225–242. doi: 10.1002/протокол.20149. [PubMed] [CrossRef] [Google Scholar]
3. Elokely K.M., Doerksen R.J. Задача стыковки: отбор проб белков и молекулярная стыковка. Дж. Хим. Инф. Модель. 2013;53:1934–1945. doi: 10.1021/ci400040d. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Kitchen D.B., Decornez H., Furr J.R., Bajorath J. Стыковка и оценка в виртуальном скрининге для обнаружения лекарств: методы и приложения. Нац. Преподобный Друг Дисков. 2004; 3: 935–949. doi: 10.1038/nrd1549. [PubMed] [CrossRef] [Академия Google]
5. Эриксон Дж.А., Джалаи М., Робертсон Д.Х., Льюис Р.А., Вит М. Уроки молекулярного распознавания: влияние гибкости лиганда и белка на точность молекулярного докинга. Дж. Мед. хим. 2004; 47:45–55. doi: 10.1021/jm030209y. [PubMed] [CrossRef] [Google Scholar]
Уроки молекулярного распознавания: влияние гибкости лиганда и белка на точность молекулярного докинга. Дж. Мед. хим. 2004; 47:45–55. doi: 10.1021/jm030209y. [PubMed] [CrossRef] [Google Scholar]
6. Сазерленд Дж.Дж., Нандигам Р.К., Эриксон Дж.А., Вит М. Уроки молекулярного распознавания. 2. Оценка и повышение точности кросс-докинга. Дж. Хим. Инф. Модель. 2007; 47: 2293–2302. doi: 10.1021/ci700253h. [PubMed] [CrossRef] [Академия Google]
7. Балланте Ф., Маршалл Г.Р. Автоматизированная стратегия выбора позы связывания и оценки стыковки при разработке лекарств на основе структуры. Дж. Хим. Инф. Модель. 2016;56:54–72. doi: 10.1021/acs.jcim.5b00603. [PubMed] [CrossRef] [Google Scholar]
8. Mena-Ulecia K., Tiznado W., Caballero J. Изучение дифференциальной активности ингибиторов тромбина с использованием докинга, QSAR, молекулярной динамики и MM-GBSA. ПЛОС ОДИН. 2015;10:e0142774. doi: 10.1371/journal.pone.0142774. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Кесада-Ромеро Л., Мена-Улесия К., Тизнадо В., Кабальеро Дж. Взгляд на взаимодействие между производными малеимида и GSK3β, объединяющий молекулярный докинг и QSAR. ПЛОС ОДИН. 2014;9:e102212. doi: 10.1371/journal.pone.0102212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Кесада-Ромеро Л., Мена-Улесия К., Тизнадо В., Кабальеро Дж. Взгляд на взаимодействие между производными малеимида и GSK3β, объединяющий молекулярный докинг и QSAR. ПЛОС ОДИН. 2014;9:e102212. doi: 10.1371/journal.pone.0102212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Caballero J., Zilocchi S., Tiznado W., Collina S. Исследования докинга и количественных взаимосвязей между структурой и активностью для имидазо[1,2-a ]пиразины как ингибиторы контрольной точки киназы-1. Мед. хим. Рез. 2012;21:1912–1920. doi: 10.1007/s00044-011-9714-1. [CrossRef] [Google Scholar]
11. Caballero J., Vergara-Jaque A., Fernández M., Coll D. Исследования докинга и количественных взаимосвязей между структурой и активностью сульфонилгидразидов как ингибиторов цитозольной аминотрансферазы аминокислот с разветвленной цепью человека. . Мол. Дайверы. 2009; 13: 493–500. doi: 10.1007/s11030-009-9140-1. [PubMed] [CrossRef] [Google Scholar]
12. Caballero J., Quiliano M., Alzate-Morales J. H., Zimic M., Deharo E. Исследования докинга и количественных взаимосвязей между структурой и активностью для 3-фтор-4-( пирроло[2,1-f][1,2,4]триазин-4-илокси)анилин, 3-фтор-4-(1, H -пирроло[2,3-b]пиридин-4-илокси)анилин и производные 4-(4-амино-2-фторфенокси)-2-пиридиниламина в качестве ингибиторов c-Met киназы. Дж. Вычисл. Помощь Мол. Дес. 2011;25:349–369. doi: 10.1007/s10822-011-9425-1. [PubMed] [CrossRef] [Google Scholar]
H., Zimic M., Deharo E. Исследования докинга и количественных взаимосвязей между структурой и активностью для 3-фтор-4-( пирроло[2,1-f][1,2,4]триазин-4-илокси)анилин, 3-фтор-4-(1, H -пирроло[2,3-b]пиридин-4-илокси)анилин и производные 4-(4-амино-2-фторфенокси)-2-пиридиниламина в качестве ингибиторов c-Met киназы. Дж. Вычисл. Помощь Мол. Дес. 2011;25:349–369. doi: 10.1007/s10822-011-9425-1. [PubMed] [CrossRef] [Google Scholar]
13. Alzate-Morales J.H., Caballero J., Vergara-Jaque A., Gonzalez-Nilo F.D. Взгляд на структурную основу N2 и O6 замещенных производных гуанина в качестве ингибиторов циклинзависимой киназы 2 (CDK2): прогнозирование способов связывания и эффективности ингибиторов путем докинга и расчетов ONIOM. Дж. Хим. Инф. Модель. 2009 г.;49:886–899. doi: 10.1021/ci8004034. [PubMed] [CrossRef] [Google Scholar]
14. Alzate-Morales J.H., Vergara-Jaque A., Caballero J. Вычислительное исследование взаимодействия N1-замещенных производных пиразола с киназой B-Raf: необычная водородная проволока. Сеть связей и новые взаимодействия на входе в активный сайт. Дж. Хим. Инф. Модель. 2010;50:1101–1112. doi: 10.1021/ci100049h. [PubMed] [CrossRef] [Google Scholar]
Сеть связей и новые взаимодействия на входе в активный сайт. Дж. Хим. Инф. Модель. 2010;50:1101–1112. doi: 10.1021/ci100049h. [PubMed] [CrossRef] [Google Scholar]
15. Рамирес Д., Кабальеро Дж. Надежно ли использовать общие методы молекулярной стыковки для сравнения сродства связывания пар энантиомеров с их белком-мишенью? Междунар. Дж. Мол. науч. 2016;17:525. дои: 10.3390/ijms17040525. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Kroemer R.T. Дизайн лекарств на основе структуры: стыковка и оценка. Курс. прот. Пептидная наука. 2007; 8: 312–328. doi: 10.2174/138920307781369382. [PubMed] [CrossRef] [Google Scholar]
17. Meng X.-Y., Zhang H.-X., Mezei M., Cui M. Молекулярный докинг: мощный подход к открытию лекарств на основе структуры. Курс. вычисл. Помощь наркотиков Des. 2011;7:146. doi: 10.2174/157340911795677602. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Friesner R.A., Banks J.L., Murphy R.B., Halgren T.A., Klicic J. J., Mainz D.T., Repasky M.P., Knoll E.H., Shelley M., Perry J.K., et al. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1. Методика и оценка точности стыковки. Дж. Мед. хим. 2004; 47: 1739–1749. doi: 10.1021/jm0306430. [PubMed] [CrossRef] [Google Scholar]
J., Mainz D.T., Repasky M.P., Knoll E.H., Shelley M., Perry J.K., et al. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1. Методика и оценка точности стыковки. Дж. Мед. хим. 2004; 47: 1739–1749. doi: 10.1021/jm0306430. [PubMed] [CrossRef] [Google Scholar]
19. Halgren T.A., Murphy R.B., Friesner R.A., Beard H.S., Frye L.L., Pollard W.T., Banks J.L. Glide: новый подход для быстрой и точной стыковки и оценки. 2. Факторы обогащения при проверке базы данных. Дж. Мед. хим. 2004; 47:1750–1759.. doi: 10.1021/jm030644s. [PubMed] [CrossRef] [Google Scholar]
20. Friesner R.A., Murphy R.B., Repasky M.P., Frye L.L., Greenwood J.R., Halgren T.A., Sanschagrin P.C., Mainz DT. для белково-лигандных комплексов. Дж. Мед. хим. 2006; 49: 6177–6196. doi: 10.1021/jm051256o. [PubMed] [CrossRef] [Google Scholar]
21. Гудселл Д.С., Моррис Г.М., Олсон А.Дж. Автоматизированная стыковка гибких лигандов: приложения AutoDock. Дж. Мол. Признать. 1996;9:1–5. doi: 10.1002/(SICI)1099-1352(199601)9:1<1::AID-JMR241>3. 0.CO;2-6. [PubMed] [CrossRef] [Google Scholar]
0.CO;2-6. [PubMed] [CrossRef] [Google Scholar]
22. Gohlke H., Hendlich M., Klebe G. Функция оценки, основанная на знаниях, для прогнозирования взаимодействий белок-лиганд. Дж. Мол. биол. 2000; 295:337–356. doi: 10.1006/jmbi.1999.3371. [PubMed] [CrossRef] [Google Scholar]
23. Binda C., Hubalek F., Li M., Herzig Y., Sterling J., Edmondson D.E., Mattevi A. Кристаллические структуры моноаминоксидазы B в комплексе с четырьмя ингибиторы N -Класс пропаргиламиноиндана. Дж. Мед. хим. 2004; 47: 1767–1774. doi: 10.1021/jm031087c. [PubMed] [CrossRef] [Google Scholar]
24. Binda C., Wang J., Pisani L., Caccia C., Carotti A., Salvati P., Edmondson D.E., Mattevi A. Структуры моноаминоксидазы B человека Комплексы с селективными нековалентными ингибиторами: аналоги сафинамида и кумарина. Дж. Мед. хим. 2007; 50: 5848–5852. doi: 10.1021/jm070677y. [PubMed] [CrossRef] [Google Scholar]
25. Binda C., Li M., Hubalek F., Restelli N., Edmondson D.E., Mattevi A. Insights in the Mode of Inhibition of Human Mythondrial Monoamine Oxidase B from High -Разрешение кристаллических структур. проц. Натл. акад. науч. США. 2003;100:9750–9755. doi: 10.1073/pnas.1633804100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 2003;100:9750–9755. doi: 10.1073/pnas.1633804100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Binda C., Hubalek F., Li M., Herzig Y., Sterling J., Edmondson D.E., Mattevi A. Binding of Rasagiline-Rerelated Ингибиторы моноаминоксидаз человека: кинетический и кристаллографический анализ. Дж. Мед. хим. 2005; 48:8148–8154. doi: 10.1021/jm0506266. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Milczek E.M., Bonivento D., Binda C., Mattevi A., Mcdonald I.A., Edmondson D.E. Структурные и механистические исследования ингибирования мофегилином рекомбинантной моноаминоксидазы человека B. J. Med. хим. 2008;51:8019–8026. дои: 10.1021/jm8011867. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Binda C., Aldeco M., Geldenhuys W.J., Tortorici M., Mattevi A., Edmondson D.E. Молекулярные исследования ингибирования моноаминоксидазы B человека антидиабетическими препаратами глитазона. АКС Мед. хим. лат. 2012;3:39–42. doi: 10.1021/ml200196p. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
лат. 2012;3:39–42. doi: 10.1021/ml200196p. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. De Colibus L., Li M., Binda C., Lustig A., Edmondson D.E., Mattevi A. Трехмерная структура моноаминоксидазы человека a (Mao A): Связь со структурами Rat Mao a и Human Mao B. Proc. Натл. акад. науч. США. 2005;102:12864–12869. doi: 10.1073/pnas.0505975102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Lu T., Markotan T., Coppo F., Tomczuk B., Crysler C., Eisennagel S., Spurlino J., Gremminger L. , Soll R.M., Giardino E.C., et al. Оксигуанидины. Часть 2: Открытие нового перорально активного ингибитора тромбина с помощью разработки лекарств на основе структуры и параллельного синтеза. биоорг. Мед. хим. лат. 2004; 14:3727–3731. doi: 10.1016/j.bmcl.2004.05.002. [PubMed] [CrossRef] [Google Scholar]
31. Ruehmann E., Betz M., Heine A., Klebe G. Фрагменты могут связывать либо больше энтальпии, либо энтропию: кристаллические структуры и модель остаточной гидратации показывают, почему. Дж. Мед. хим. 2015;58:6960–6971. doi: 10.1021/acs.jmedchem.5b00812. [PubMed] [CrossRef] [Google Scholar]
Дж. Мед. хим. 2015;58:6960–6971. doi: 10.1021/acs.jmedchem.5b00812. [PubMed] [CrossRef] [Google Scholar]
32. Lee L., Kreutter K.D., Pan W., Crysler C., Spurlino J., Player MP, Tomczuk B., Lu T. 2-(2-Chloro- 6-фторфенил)ацетамиды как мощные ингибиторы тромбина. биоорг. Мед. хим. лат. 2007; 17: 6266–6269. doi: 10.1016/j.bmcl.2007.09.013. [PubMed] [CrossRef] [Google Scholar]
33. Biela A., Khayat M., Tan H., Kong J., Heine A., Hangauer D., Klebe G. Влияние десольватации лиганда и белка на связывание лиганда к карману S1 тромбина. Дж. Мол. биол. 2012; 418:350–366. doi: 10.1016/j.jmb.2012.01.054. [PubMed] [CrossRef] [Академия Google]
34. Чен З., Ли Ю., Муличак А.М., Льюис С.Д., Шафер Дж.А. Кристаллическая структура альфа-тромбина человека в комплексе с гиругеном и п-амидинофенилпируватом при разрешении 1,6 Å. Арка Биохим. Биофиз. 1995; 322:198–203. doi: 10.1006/abbi.1995.1452. [PubMed] [CrossRef] [Google Scholar]
35. Meneyrol J., Follmann M., Lassalle G., Wehner V. , Barre G., Rousseaux T., Altenburger J.M., Petit F., Bockei Z., Schreuder Х. и др. 5-Хлортиофен-2-карбоновая кислота [( S )-2-[2-метил-3-(2-оксопирролидин-1-ил)бензолсульфониламино]-3-(4-метилпиперазин-1-ил)-3- оксопропил]амид (SAR107375), селективный и сильнодействующий перорально активный двойной ингибитор тромбина и фактора Ха. Дж. Мед. хим. 2013;56:9441–9456. дои: 10.1021/jm4005835. [PubMed] [CrossRef] [Google Scholar]
, Barre G., Rousseaux T., Altenburger J.M., Petit F., Bockei Z., Schreuder Х. и др. 5-Хлортиофен-2-карбоновая кислота [( S )-2-[2-метил-3-(2-оксопирролидин-1-ил)бензолсульфониламино]-3-(4-метилпиперазин-1-ил)-3- оксопропил]амид (SAR107375), селективный и сильнодействующий перорально активный двойной ингибитор тромбина и фактора Ха. Дж. Мед. хим. 2013;56:9441–9456. дои: 10.1021/jm4005835. [PubMed] [CrossRef] [Google Scholar]
36. Biela A., Sielaff F., Terwesten F., Heine A., Steinmetzer T., Klebe G. Связывание лиганда поэтапно разрушает водную сеть в тромбине: энтальпийные и энтропийные изменения проявляют классический гидрофобный эффект. Дж. Мед. хим. 2012;55:6094–6110. doi: 10.1021/jm300337q. [PubMed] [CrossRef] [Google Scholar]
37. Zhang C., Spevak W., Zhang Y., Burton E.A., Ma Y., Habets G., Zhang J., Lin J., Ewing T., Matusow Б. и др. Ингибиторы RAF, которые избегают активации парадоксального пути MAPK. Природа. 2015; 526: 583–586. дои: 10.1038/nature14982. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
38. Вайзенеггер И.С., Баум А., Штёрер С., Штадтмюллер Х., Бадер Г., Шааф О., Гарин-Чеза П., Шлаттль А., Швайфер Н., Хаслингер С. и соавт. Новый ингибитор киназы RAF с режимом DFG-Out-Binding: высокая эффективность в моделях ксенотрансплантата мутантной опухоли BRAF в отсутствие гиперпролиферации нормальной ткани. Мол. Рак Тер. 2016;15:354–365. doi: 10.1158/1535-7163.MCT-15-0617. [PubMed] [CrossRef] [Google Scholar]
39. Qin J., Xie P., Ventocilla C., Zhou G., Vultur A., Chen Q., Liu Q., Herlyn M., Winkler J., Марморштейн Р. Идентификация нового семейства ингибиторов BRAF(V600E). Дж. Мед. хим. 2012;55:5220–5230. doi: 10.1021/jm3004416. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Tsai J., Lee J.T., Wang W., Zhang J., Cho H., Mamo S., Bremer R., Gillette S., Kong J., Haass N.K., et al. Открытие селективного ингибитора онкогенной киназы B-Raf с мощной активностью против меланомы. проц. Натл. акад. науч. США. 2008; 105:3041–3046. doi: 10.1073/pnas.0711741105. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2008; 105:3041–3046. doi: 10.1073/pnas.0711741105. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
GSK114: селективный ингибитор для выяснения биологической роли TNNI3K. биоорг. Мед. хим. лат. 2016;26:3355–3358. doi: 10.1016/j.bmcl.2016.05.033. [PubMed] [CrossRef] [Академия Google]
42. Хансен Дж.Д., Грина Дж., Ньюхаус Б., Уэлч М., Топалов Г., Литтман Н., Кальехо М., Глор С., Мартинсон М., Лэрд Э. и др. Мощные и селективные ингибиторы киназы B-Raf на основе пиразола. биоорг. Мед. хим. лат. 2008;18:4692–4695. doi: 10.1016/j.bmcl.2008.07.002. [PubMed] [CrossRef] [Google Scholar]
43. Кинг А.Дж., Патрик Д.Р., Баторский Р.С., Хо М.Л., До Х.Т., Чжан С.Ю., Кумар Р., Руснак Д.В., Такле А.К., Уилсон Д.М. и др. Демонстрация генетического терапевтического индекса опухолей, экспрессирующих онкогенный BRAF, с помощью ингибитора киназы SB-590885. Рак Res. 2006;66:11100–11105. doi: 10.1158/0008-5472.CAN-06-2554. [PubMed] [CrossRef] [Google Scholar]
44. Ren L. , Wenglowsky S., Miknis G., Rast B., Buckmelter A.J., Ely R.J., Schlachter S., Laird E.R., Randolph N., Callejo M. , и другие. Неоксимные ингибиторы киназы B-Raf(V600E). биоорг. Мед. хим. лат. 2011;21:1243–1247. doi: 10.1016/j.bmcl.2010.12.061. [PubMed] [CrossRef] [Google Scholar]
, Wenglowsky S., Miknis G., Rast B., Buckmelter A.J., Ely R.J., Schlachter S., Laird E.R., Randolph N., Callejo M. , и другие. Неоксимные ингибиторы киназы B-Raf(V600E). биоорг. Мед. хим. лат. 2011;21:1243–1247. doi: 10.1016/j.bmcl.2010.12.061. [PubMed] [CrossRef] [Google Scholar]
45. Оканива М., Хиросе М., Арита Т., Ябуки М., Накамура А., Такаги Т., Кавамото Т., Утияма Н., Сумита А., Цуцуми С. и др. Открытие селективного ингибитора киназы (TAK-632), нацеленного на ингибирование Pan-RAF: дизайн, синтез и биологическая оценка производных C-7-замещенного 1,3-бензотиазола. Дж. Мед. хим. 2013; 56:6478–6494. doi: 10.1021/jm400778d. [PubMed] [CrossRef] [Google Scholar]
46. Caballero J., Alzate-Morales J.H., Vergara-Jaque A. Исследование различий в активности между гидроксициклоалкил-N1-замещенными производными пиразола в качестве ингибиторов киназы B-Raf с помощью докинга. , молекулярная динамика, QM / MM и дизайн de novo на основе фрагментов: изучение способа связывания диастереомерных соединений. Дж. Хим. Инф. Модель. 2011;51:2920–2931. doi: 10.1021/ci200306w. [PubMed] [CrossRef] [Академия Google]
Дж. Хим. Инф. Модель. 2011;51:2920–2931. doi: 10.1021/ci200306w. [PubMed] [CrossRef] [Академия Google]
47. Ю Дж., Чжоу Ю., Танака И., Яо М. Ролл: Новый алгоритм обнаружения белковых карманов и полостей с помощью вращающейся сферы-зонда. Биоинформатика. 2010; 26:46–52. doi: 10.1093/биоинформатика/btp599. [PubMed] [CrossRef] [Google Scholar]
48. Верховкер Г.М., Бузида Д., Гельхаар Д.К., Рейто П.А., Артурс С., Колсон А.Б., Фрир С.Т., Ларсон В., Люти Б.А., Марроне Т. и др. . Расшифровка распространенных сбоев при молекулярном докинге лиганд-белковых комплексов. Дж. Вычисл. Помощь Мол. Дес. 2000; 14: 731–751. doi: 10.1023/A:1008158231558. [PubMed] [CrossRef] [Академия Google]
49. Muñoz-Gutierrez C., Adasme-Carreño F., Fuentes E., Palomo I., Caballero J. Вычислительное исследование ориентации связывания и аффинности агонистов PPARγ: включение лиганд-индуцированной подгонки путем кросс-докинга. RSC Adv. 2016;6:64756–64768. doi: 10.1039/C6RA12084A. [CrossRef] [Google Scholar]
50. Баррека М.Л., Ираси Н., Де Лука Л., Чимирри А. Подход с индуцированной подгонкой дает представление о способе связывания и механизме действия ингибиторов интегразы ВИЧ-1. ХимМедХим. 2009 г.;4:1446–1456. doi: 10.1002/cmdc.200
Баррека М.Л., Ираси Н., Де Лука Л., Чимирри А. Подход с индуцированной подгонкой дает представление о способе связывания и механизме действия ингибиторов интегразы ВИЧ-1. ХимМедХим. 2009 г.;4:1446–1456. doi: 10.1002/cmdc.200
6. [PubMed] [CrossRef] [Google Scholar]
51. Калудерчич Н., Карпи А., Менабо Р., Ди Лиза Ф., Паолоччи Н. Моноаминоксидазы (МАО) в патогенезе сердечной недостаточности и ишемического/реперфузионного повреждения . Биохим. Биофиз. Акта. 2011; 1813: 1323–1332. doi: 10.1016/j.bbamcr.2010.09.010. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Riederer P., Laux G. Ингибиторы МАО при болезни Паркинсона. Эксп. Нейробиол. 2011; 20:1–17. doi: 10.5607/en.2011.20.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Szökő É., Tábi T., Riederer P., Vécsei L., Magyar K. Фармакологические аспекты нейропротекторного действия необратимых ингибиторов МАО-В, селегилина и разагилина, при болезни Паркинсона. J. Нейронная передача. (Вена) 2018 г. doi: 10.1007/s00702-018-1853-9. [PubMed] [CrossRef] [Google Scholar]
(Вена) 2018 г. doi: 10.1007/s00702-018-1853-9. [PubMed] [CrossRef] [Google Scholar]
54. Танака К.А., Ки Н.С., Леви Дж.Х. Свертывание крови: гемостаз и регуляция тромбина. Анест. аналг. 2009; 108:1433–1446. doi: 10.1213/ane.0b013e31819bcc9c. [PubMed] [CrossRef] [Академия Google]
55. Стрингер К.А., Линденфельд Дж. Хирудинс: Антитромбиновые антикоагулянты. Анна. Фармацевт. 1992; 26: 1535–1540. doi: 10.1177/106002809202601211. [PubMed] [CrossRef] [Google Scholar]
56. Xiao Z., Théroux P. Активация тромбоцитов нефракционированным гепарином в терапевтических концентрациях и сравнение с низкомолекулярным гепарином и прямым ингибитором тромбина. Тираж. 1998; 97: 251–256. doi: 10.1161/01.CIR.97.3.251. [PubMed] [CrossRef] [Академия Google]
57. Албан С. Фармакологические стратегии ингибирования активности тромбина. Курс. фарм. Дес. 2008; 14:1152–1175. doi: 10.2174/138161208784246135. [PubMed] [CrossRef] [Google Scholar]
58. Mercer K.E., Pritchard C.A. Белки Raf и рак: B-Raf идентифицирован как мутационная мишень. Биохим. Биофиз. Акта. 2003; 1653: 25–40. doi: 10.1016/S0304-419X(03)00016-7. [PubMed] [CrossRef] [Google Scholar]
Биохим. Биофиз. Акта. 2003; 1653: 25–40. doi: 10.1016/S0304-419X(03)00016-7. [PubMed] [CrossRef] [Google Scholar]
59. Garnett M.J., Marais R. Обвинение: B-RAF является онкогеном человека. Раковая клетка. 2004; 6: 313–319.. doi: 10.1016/j.ccr.2004.09.022. [PubMed] [CrossRef] [Google Scholar]
60. Li N., Batt D., Warmuth M. Ингибиторы киназы B-Raf для лечения рака. Курс. мнение расследование Наркотики. 2007; 8: 452–456. [PubMed] [Google Scholar]
61. Йоргенсен В.Л., Максвелл Д.С., Тирадо-Ривз Дж. Разработка и тестирование силового поля всех атомов OPLS на конформационную энергетику и свойства органических жидкостей. Варенье. хим. соц. 1996; 118:11225–11236. doi: 10.1021/ja9621760. [Перекрестная ссылка] [Академия Google]
62. Caporuscio F., Rastelli G., Imbriano C., Del Rio A. Дизайн сильнодействующих ингибиторов ароматазы на основе структуры с помощью высокопроизводительного докинга. Дж. Мед. хим. 2011;54:4006–4017. doi: 10.1021/jm2000689. [PubMed] [CrossRef] [Google Scholar]
63. Abdul-Hay S.O., Lane A.L., Caulfield T.R., Claussin C., Bertrand J., Masson A., Choudhry S., Fauq A.H., Maharvi G.M., Leissring M.A. Оптимизация пептидных гидроксаматных ингибиторов фермента, разлагающего инсулин, обнаруживает заметную субстратную селективность. Дж. Мед. хим. 2013;56:2246–2255. doi: 10.1021/jm301280p. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Abdul-Hay S.O., Lane A.L., Caulfield T.R., Claussin C., Bertrand J., Masson A., Choudhry S., Fauq A.H., Maharvi G.M., Leissring M.A. Оптимизация пептидных гидроксаматных ингибиторов фермента, разлагающего инсулин, обнаруживает заметную субстратную селективность. Дж. Мед. хим. 2013;56:2246–2255. doi: 10.1021/jm301280p. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Осгуторп Д.Дж., Шерман В., Хаглер А.Т. Создание структурных ансамблей рецепторов для виртуального скрининга с использованием анализа формы сайта связывания и кластеризации. хим. биол. Препарат Дез. 2012; 80: 182–193. doi: 10.1111/j.1747-0285.2012.01396.x. [PubMed] [CrossRef] [Google Scholar]
65. Аманинг К., Ловински М., Валле Ф., Штайер В., Марсиро К., Уголини А., Делорм К., Фуко Ф., Маккорт Г., Деримей Н. и др. Использование виртуального скрининга и дифференциальной сканирующей флуориметрии для быстрой идентификации фрагментов, активных в отношении MEK1. биоорг. Мед. хим. лат. 2013;23:3620–3626. doi: 10.1016/j.bmcl.2013.04.003. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.bmcl.2013.04.003. [PubMed] [CrossRef] [Академия Google]
66. Рамирес Д. Вычислительные методы для рационального дизайна лекарств. Открытая мед. хим. Дж. 2016; 10:7–20. doi: 10.2174/1874104501610010007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Оценка и репараметризация силового поля OPLS-AA для белков путем сравнения с точными квантово-химическими расчетами для пептидов. Дж. Физ. хим. Б. 2001; 105:6474–6487. doi: 10.1021/jp003919d. [Перекрестная ссылка] [Академия Google]
68. Элдридж М.Д., Мюррей К.В., Аутон Т.Р., Паолини Г.В., Ми Р.П. Эмпирические оценочные функции: I. Разработка быстрой эмпирической оценочной функции для оценки аффинности связывания лигандов в рецепторных комплексах. Дж. Вычисл. Помощь Мол. Дес. 1997; 11: 425–445. doi: 10.1023/A:1007996124545. [PubMed] [CrossRef] [Google Scholar]
69. Хьюи Р., Моррис Г.М., Олсон А.Дж., Гудселл Д.С. Полуэмпирическое силовое поле свободной энергии с десольватацией на основе заряда.

 5
5 5
5 5
5 5
5 5
5 5
5 Могут применяться для установки в помещения жилого направления, а также в ванную, туалет. Следует отметить простоту и удобство монтажа, что обеспечивается пластичностью.
Могут применяться для установки в помещения жилого направления, а также в ванную, туалет. Следует отметить простоту и удобство монтажа, что обеспечивается пластичностью.