Буферное действие сильных кислот и оснований
Растворы, которые обладают свойством поддерживать в определенных границах постоянной величину pH при добавлении к ним сильных кислот, щелочей, а также при разбавлении, называются буферными. Буферные растворы представляют собой чаще всего растворы слабой кислоты и хорошо диссоциированной соли этой кислоты (сильного электролита) или раствора слабого основания и его хорошо диссоциированной соли. Для выяснения механизма буферного действия рассмотрим в качестве примера буферную смесь, состоящую из слабой уксусной кислоты и ацетата натрия — сильного, практически полностью диссоциированного электролита [c.184]Буферные растворы представляют собой смеси слабых кислот солями этих же слабых кислот и.ли смеси слабых оснований с солями слабых оснований. Причина буферного действия таких смесей понятна. Если в раствор, содержащий СНзСООН и СНзСООМа (уксусноацетатный буферный раствор) ввести некоторое количество сильной кислоты НС1, то она будет реагировать с ацетат-ионами, образуя эквивалентное количество СНзСООН
 280]
280]Горизонтальные участки на кривой титрования сильной кислоты сильным основанием (см. рис. 6.2) свидетельствуют о малом изменении pH раствора в начальный и конечный моменты титрования. Незначительное изменение pH раствора в начале титрования объясняется тем, что в растворе кислота находится еще в большем избытке по отношению к количеству прибавленной щелочи. Способность раствора поддерживать определенное значение pH называется буферным действием. Буферное действие раствора измеряется буферной емкостью, т. е. тем количе- [c.321]
Буферный раствор — смесь слабой кислоты или слабого основания с собственной солью, мало меняющая pH при разбавлении раствора в пределах 0,1—0,0001 н., а также при добавлении небольшого количества свободной кислоты или свободной щелочи. Буферной емкостью раствора называют число молей сильного основания, которое, будучи добавлено к 1 л раствора, повышает pH на 1, или число молей сильной кислоты, которое, будучи добавлено к 1 л раствора, понижает pH на 1.
Разбавленные растворы сильных кислот и оснований при их дальнейшем разбавлении или при добавлении к ним кислоты (щелочи) легко изменяют значение pH. Однако на практике часто возникает необходимость иметь раствор с постоянным водородным показателем, не изменяющимся при добавлении к этому раствору кислоты или щелочи, а также при разбавлении его. Способность растворов сохранять определенное значение водородного показателя называется буферным действием, а растворы, обладающие буферным действием, принято наз ывать буферными растворами.
Наконец, из кривых титрования сильных кислот сильными основаниями или наоборот (см. рис. 45 и 46) видно, что и сильные кислоты, и сильные основания, если концентрации их в растворе достаточно велики, также обладают буферным действием, так как и зде ь соответствующие участки кривой титрования являются [c.281]
Буферное действие сильных и слабых кислот и сильных оснований представлено на рис. V. . Прежде всего очевидно, что сильные кислоты и основания имеют большую буферность, чем слабокислые буферные растворы той же концентрации. Кроме того, максимум буферной емкости ацетатной, фталатной, фосфатной и боратной систем примерно таков, как это предсказывает уравнение (У.15), а именно 0,028 для 0,05 М систем, 0,057 для 0,1 М систем и 0,115 для 0,2 М систем. [c.99]
Нужную концентрацию ионов Н3О+ или ОН в растворах создают обычно добавлением сильных кислот или оснований. Однако при расчетах количества вводимого сильного электролита следует иметь в виду, что растворы, к которым добавляют сильный электролит, могут оказывать буферное действие, т. е. уменьшать влияние сильных электролитов. Сильное буферное действие оказывают растворы сильных кислот и оснований, а также специальные растворы, называемые буферными. [c.57]
Однако при расчетах количества вводимого сильного электролита следует иметь в виду, что растворы, к которым добавляют сильный электролит, могут оказывать буферное действие, т. е. уменьшать влияние сильных электролитов. Сильное буферное действие оказывают растворы сильных кислот и оснований, а также специальные растворы, называемые буферными. [c.57]
Буферная способность почвы зависит не только от состава почвенного раствора, но и от свойств твердой фазы почвы. Роль буферности почвенного раствора в общей буферной способности почвы обычно очень невелика. Более сильным фактором буферного действия в почве является твердая фаза, главным образом ее коллоидная часть. Буферная способность почвы в основном зависит от содержания и состава обменных катионов в почвенном поглощающем комплексе. Чем больше емкость поглощения почвы, тем выше ее буферность. Против подкисления буферное действие оказывают поглощенные основания (Са, Mg и др.). Если в почве, насыщенной основаниями, появляется кислота (наПример, Н28 04 при внесении сульфата аммония), [c. 134]
134]
Кислотно-основное титрование. При титровании сильной кислоты сильным основанием получают кривую, представленную на рис. Д.134, а. При титровании сильной кислотьг слабым основанием, например гидроксидом аммония, после точки эквивалентности угол подъема прямой невелик, что связано с диссоциацией образовавшейся соли и подавлением диссоциации избытка основания (буферное действие катионов соли, В данном случае ЫН4+). Кривая титрования представлена на рис. Д.134,б. В случае титрования сильного основания слабой кислотой кривая будет такой же. Кривые титрования слабого основания (или кислоты) сильной кислотой (или основанием) имеют другой вид. Слабое основание (или кислота) слабо диссоциирует, и поэтому растворы- его имеют небольшую электро- [c.324]
Чтобы найти условия получения максимальной буферной емкости, нужно выражение йл/й-Св приравнять нулю, что выполняется, если Сд = Св = С/2. Другими словами, для данной общей концентрации компонентов буферного раствора максимальная буферная емкость имеет место при равной концентрации обоих компонентов. Для определенного соотношения Сд/Св буферная емкость пропорциональна общей концентрации С. Очень важно понять, что при добавлении к буферному раствору сильной кислоты или основания концентрации обоих компонентов — Сд и Св — изменяются. Следовательно, наличие высокой концентрации кислоты А еще недостаточно для того, чтобы раствор оказывал буферное действие при добавлении сильного основания и наоборот. Уравнение (3-71), содержащее произведение двух концентраций, наглядно подтверждает это.
Для определенного соотношения Сд/Св буферная емкость пропорциональна общей концентрации С. Очень важно понять, что при добавлении к буферному раствору сильной кислоты или основания концентрации обоих компонентов — Сд и Св — изменяются. Следовательно, наличие высокой концентрации кислоты А еще недостаточно для того, чтобы раствор оказывал буферное действие при добавлении сильного основания и наоборот. Уравнение (3-71), содержащее произведение двух концентраций, наглядно подтверждает это.
Первый член этого уравнения тот же, что и в уравнении (10) раздела IV. 4 (стр. 99), описывающем титрование в системе сильная кислота — сильное основание. Второй член появился в результате буферного действия слабой кислоты в конечной точке. [c.140]
Почва, насыщенная основаниями, обладает заметным буферным действием против кислот. Так, если в нее внесен сульфат аммония, то в растворе он распадается на ионы аммония и сульфатный. Растения сильнее поглощают аммоний, и в растворе накапливается серная кислота.
Предел, в котором проявляется буферное действие, называется буферной емкостью. Буферную емкость выражают количеством вещества эквивалента сильной кислоты или основания, которое следует добавить к 1 буферного раствора, чтобы сместить pH на единицу, т. е. [c.215]
Величину буферного действия характеризуют с помощью буферной емкости, равной числу молярных масс эквивалента сильной кислоты или сильного основания, которое можно добавить к 1 л буферного раствора, чтобы pH изменился на единицу. [c.97]
Буферное действие такой системы связано с тем, что в ней имеется противоядие и против ионов водорода, и против гидроксид-ионов. При введении в ацетатный буфер сильной кислоты равновесие (3.57) несколько сдвинется влево, а при введении сильного основания — вправо. Поскольку в растворе в достаточном количестве имеется и уксусная кислота, и ацетат натрия, заметного изменения pH не происходит.
Буферная емкость может быть рассчитана аналитически. Буферное действие увеличивается при переходе к растворам слабых кислот или слабых оснований, особенно в присутствии соответствующих солей. Если к раствору, содержащему п г-экв слабой кислоты, добавлено т г-экв сильного основания п>т) и [c.318]
Буферная емкость раствора тем выше, чем больше концентрация компонентов (кислоты и ее соли, основания и его соли). Как следует из уравнения (13.7), наибольшей буферной емкостью обладает раствор с одинаковой концентрацией компонентов. В этом случае Ig (Скисл/Ссоли) =0, а рН = р7( и pH изменится на 1 лишь при изменении концентрации кислоты или соли в 10 раз. Разбавление раствора не влияет заметно на изменение pH, но сильно влияет на буферную емкость. Буферное действие прекращается, как только один из компонентов раствора израсходуется примерно на 90%. [c.129]
Буферным действием обладает и раствор, образованный слабым основанием и его солью с сильной кислотой, например, водного аммиака и хлорида аммония. При добавлении (в малых количествах) ионов водорода они в значительной степени связываются с аммиаком, а добавленные гидроксид-ионы — с ионами аммония [c.294]
При добавлении (в малых количествах) ионов водорода они в значительной степени связываются с аммиаком, а добавленные гидроксид-ионы — с ионами аммония [c.294]
Эти соединения энергично взаимодействуют с формальдегидом [25], растворимы в горячей воде, водных растворах карбоната натрия и этаноле. Сама тонкоизмельченная кора, применяемая в качестве адгезива в сочетании с формальдегидом, способствует повышению прочности ДСП при растяжении. Однако кислотный характер производных фенола может играть отрицательную роль, особенно при склеивании каштановой, эвкалиптовой и дубовой древесины. Из-за кислотного характера указанных соединений водные экстракты имеют pH до 3,2, причем предполагают, что это обусловлено буферным действием соли, образованной сильным основанием и слабой кислотой. Добавление едкого натра к клею может компенсировать это воз.действие [26, 27].
Как показывает опыт, разбавленные растворы сильных кислот и оснований, обладающие слабокислой или слабощелочной реакцией, характеризуются непостоянством pH. Однако смесь, например, уксусной кислоты и ее соли Hз OONa обладает способностью сохранять постоянство pH. Можно к этой смеси добавить небольшое количество кислоты или и1елочи, а также разбавить ее, но pH раствора при этом почти ие изменится. Свойство растворов сохранять определенное значение pH называется буферным действием. Растворы, обладающие буферным действием, получили название буферных растворов или буферных смесей. [c.212]
Однако смесь, например, уксусной кислоты и ее соли Hз OONa обладает способностью сохранять постоянство pH. Можно к этой смеси добавить небольшое количество кислоты или и1елочи, а также разбавить ее, но pH раствора при этом почти ие изменится. Свойство растворов сохранять определенное значение pH называется буферным действием. Растворы, обладающие буферным действием, получили название буферных растворов или буферных смесей. [c.212]
Буферные свойства растворов сильных кислот и оснований. Растворы сильных протолитов при достаточно высокой концентрации обладают буферным действием. Сопряженными системами в этом случае являются Нз0 /Н20 (для сильных кислот) и 0Н /Н20 (для сильных оснований). Поскольку концентрация Н2О велика, введение в такие растворы небольших количеств сильной кислоты или основания приводит к связыванию их с Н2О в ионы лиония шш лиата. [c.137]
При добавлении сильной кислоты или основания Д/п увеличивается один член буферного отношения (числитель или знаменатель) и уменьшается на ту же величину другой. Поэтому необходимым условием высокого буферного действия является требование, чтобы величина т1 +Ат) т2 +Ат) не отличалась бы значительно от т /т — той величины буферного отношения, которая была до добавления кислоты или щелочи. Очевидно, при высокой концентрации обоих компонентов буфера влияние величины Ат будет значительно меньше. Кроме того, если фиксирована общая концентрация слабого электролита т + Ш2, то буферное действие достигнет максимальной величины, когда т1==Ш2, т. е. когда нейтрализована половина слабой кислоты или основания. Условием максимальной эффективности буфера в частном случае является равенство pH величине — 1 /С. [c.96]
Поэтому необходимым условием высокого буферного действия является требование, чтобы величина т1 +Ат) т2 +Ат) не отличалась бы значительно от т /т — той величины буферного отношения, которая была до добавления кислоты или щелочи. Очевидно, при высокой концентрации обоих компонентов буфера влияние величины Ат будет значительно меньше. Кроме того, если фиксирована общая концентрация слабого электролита т + Ш2, то буферное действие достигнет максимальной величины, когда т1==Ш2, т. е. когда нейтрализована половина слабой кислоты или основания. Условием максимальной эффективности буфера в частном случае является равенство pH величине — 1 /С. [c.96]
Сильные кислоты и основания. Остановимся, прежде всего, на буферных свойствах водных растворов сильных кислот и оснований, в которых эти растворенные вещества полностью диссоциированы. Такие растворы обычно не входят в классификацию буферные растворы , однако, пх буферное действие зачастую больше, чем у последних. [c. 96]
96]
Чтобы продолжить иллюстрацию буферного действия слабой кислоты и сопряженного ей слабого основания, сравним его с поведением раствора, не обладающего буферными свойствами, в аналогичной ситуации. В упражении 16.1 было показано, что рн раствора 0,100 М по уксусной кислоте и 0,100 М по ацетату натрия равен 4,74. Раствор с таким же pH получается при добавлении 1,8 10 моля НС1 к литру воды. Поскольку НС1-сильная кислота, в 1,8-10 М растворе НС1 концентрация иона Н (водн.) равна 1,8 10″ М, и, следовательно, его pH равен 4,74. Допустим теперь, что мы добавили к однолитровым объемам каждого из этих растворов с pH 4,74 по 1,0мл ЮМ раствора НС1, как показано на рис. 16.2. [c.117]
Буферное действие растворов слабого основания МОН (например, Nh50H, веронал, гликоколь) в присутствии его соли объясняется тем, что добавление сильной кислоты вызывает реакцию Н3О+ + МОН 2Н2О -ь М+ [c.187]
В протонной теории водные буферные растворы рассматривают как системы, состоящие из слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Так, действие ацетатного буферного раствора обусловлено парой СНзСООН и СНзСОО . При добавлении в буферный раствор сильной кислоты ее протоны связываются основанием СНзСОО , а при введении сильного основания уксусйая кислота отдает ему свои протоны и таким образом pH раствора поддерживается примерно постоянным. [c.324]
Так, действие ацетатного буферного раствора обусловлено парой СНзСООН и СНзСОО . При добавлении в буферный раствор сильной кислоты ее протоны связываются основанием СНзСОО , а при введении сильного основания уксусйая кислота отдает ему свои протоны и таким образом pH раствора поддерживается примерно постоянным. [c.324]
В химической и медицинской практике довольно часто нужны растворы с постоянным и точным значением pH. Растворы, сохраняющие неизменными значения pH при разбавлении и добавлении в них некоторого количества кислоты или основания, называются буферными. Они содержат слабые кислоты и их соли, слабые основания и их соли или соли слабых оснований и слабых кислот. Действие таких систем основано на взаимодействии их компонентов с ионами Н+1ИЛИ ОН , добавляемых к буферным растворам сильных кислот или оснований с образованием соответственно слабых кислот и их солей или слабых оснований и их солей. [c.133]
К буферным растворам относятся также смеси кислых солей многоосновных кислот, например смесь первичных и вторичных фосфатов является также буферной. Действие сильного основания и сильной кислоты ослабляется следующим образом Н РОг+ОН- НР04–+Н20 [c.171]
Действие сильного основания и сильной кислоты ослабляется следующим образом Н РОг+ОН- НР04–+Н20 [c.171]
Особенно важный тип кислотно-основ-ного равновесия устанавливается в смеси, содержащей слабую сопряженную кислот-но-основную пару. Такие смеси обладают буферным действием. Добавление к буферному раствору небольшого количества кислоты или основания вызывает в нем лишь небольшие изменения pH, поскольку буферный раствор реагирует с добавляемыми кислотой или основанием. (Напомним, что реакции между сильной кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и сильным основанием протекают практически до ко1ща.) Буферные растворы обычно готовят из слабой кислоты и соли этой кислоты или из слабого основания и соли этого основания. Двумя важными характеристиками буферного раствора являются его буферная емкость и pH. [c.136]
Величину буферного действия характеризуют с помощью буферной емкости. Буферная емкость — это расчетная величина, равная числу молярных масс эквивалента сильной кислоты НС1, n( /2h3S04) или сильного основания NaOH, и [ /гВа (ОН)2], которое нужно добавить к I л буферного раствора, чтобы pH изменился на единицу. [c.130]
[c.130]
При титровании сильной кислоты сильным основанием буферное действие растворов проявляется только в области очень, низких или очень высодих значений pH. Наименьшую буферную емкость имеет раствор в точке эквивалентности. К раствору с pH = 7 достаточно Добавить одну каплю раствора кислоты или щелочи, и pH раствора скачкообразно изменяется. [c.322]
Растворы, обладающие способностью поддерживать опреде ленное значение pH при разбавлении и при введении в раствор некоторых количеств кислоты или основания, называются бу ферньши. Согласно этому определению растворы сильных кис лот и оснований, хотя и обладают некоторым буферным действием, не могут считаться буферными, так как при введении в раствор сильной кислоты дополнительного количества сильной кислоты или в раствор щелочи дополнительного количества щелочи pH растворов изменяется так же, как изменяется pH при разбавлении растворов. [c.322]
Буферным действием обладают смеси сопряженных кислот и оснований (НХ+Х и МН++М). Сущность буферного действия заключается в том, что одно из соединений, входящих в состав буферной системы, может связывать ионы гидроксония, а другое — гидроксил-ионы в молекулы слабого электролита — кислоты, воды или основания. Например, если к смеси ЫНз-ЬЫН4+ добавить сильную кислоту НС1, произойдет реакция, в результате которой ионы Н3О+ добавленной кислоты окажутся связанными в Nh5+ [c.57]
Сущность буферного действия заключается в том, что одно из соединений, входящих в состав буферной системы, может связывать ионы гидроксония, а другое — гидроксил-ионы в молекулы слабого электролита — кислоты, воды или основания. Например, если к смеси ЫНз-ЬЫН4+ добавить сильную кислоту НС1, произойдет реакция, в результате которой ионы Н3О+ добавленной кислоты окажутся связанными в Nh5+ [c.57]
Предел, в котором проявляется буферное действие, называется буферной емкостью и обозначается обычно буквой В. Количественное значение буферной емкости определяется количеством грзмм-эквивалентов сильной кислоты или основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить значение pH на единицу [c.113]
Буферные растворы образуются 1ри титровании слабых кислот или слабых оснований. Нередко их готовят специально, если необходимо экспериментально определить pH растворов фотометрическим методом или провести химический эк пepимe т, связанный с выделением или присоединением ионсв водорода, при постоянном значении pH. Название буферные обусловлено тем, что такие растворы ие изменяют заметно pH при разбавлении или при добавлении некоторых количеств растворов сильных кислот или сильных оснований. Постоянство pH буферных растворов имеет значение в жизнедеятельности живых организмов или растений кислотность крови или растительных соков поддерживается постояпнс й из-за буферного действия содержащихся в них составных частей. Незначительное изменение pH три добавлении [c.107]
Название буферные обусловлено тем, что такие растворы ие изменяют заметно pH при разбавлении или при добавлении некоторых количеств растворов сильных кислот или сильных оснований. Постоянство pH буферных растворов имеет значение в жизнедеятельности живых организмов или растений кислотность крови или растительных соков поддерживается постояпнс й из-за буферного действия содержащихся в них составных частей. Незначительное изменение pH три добавлении [c.107]
Рассмотрим в качестве примера буферный раствор, состоящий из уксусной кислоты и ацетата натрия (ацетатный буферный раствор). Если в ацетатный буферный раствор добавить немного сильного основания (0Н ), то гидроксид-ионы свяжутся ионами Н+, образовавшимися при диссоциации молекул НС2Н3О2, 3 молекулы Н2О. Расход же слабой кислоты возместится диссоциацией молекул НС2Н3О2, и pH раствора почти не изменится. При добавлении к буферному раствору небольших количеств сильной кислоты (ионы Н+) ацетат-ионы будут связывать ионы водорода в малодиссоциированные молекулы НС2Н3О2. Таким образом, концентрация ионов Н+ в растворе заметно не увеличивается. Схема действия ацетатного буферного раствора [c.117]
Таким образом, концентрация ионов Н+ в растворе заметно не увеличивается. Схема действия ацетатного буферного раствора [c.117]
Аналогично добавление к буферному раствору небольшого количества сильного основания ОН – способно вызвать лишь незначительное изменение pH по сравнению с тем, что имело бы место для чистой воды. Следует отметить, что если в рассмотренный выше буферный раствор добавить сильное основание в количестве большем, чем исходное количество НС2Н3О2, то после исчерпания всего имеющегося в растворе количества недиссоциированной кислоты pH раствора быстро возрастет. Буферное действие раствора прекратится также, если в него добавить такое количество сильной кислоты, которое превышает имеющееся в растворе количество ионов С2Н3О2. [c.274]
Буферным действием обладают также растворы сильц ых кислот и оснований, если концентрация их достаточно велика, однако механизм буферного действия совершенно другой. Чтобы заметно изменить pH раствора смесей сильных кислот и оснований, необходимо значительно увеличить концентрации кислоты и щелочи, иначе изменения pH раствора не произойдет Например, если к 1 л 0,1 М раствора HNO3 прибавить 0,0 моль щелочи, то концентрация ионов Н понизится до 0,1 — [c. 112]
112]
Чем слабее кислота, тем выше pH в начале титрования и в области буферного действия. Следовательно, ветвь кривой титрования до ТЭ смещается в щелочную область. В ТЭ образуется основание тем более сильное, чем слабее исходная кислота, следовательно, pH смещается также в щелочную область. В то же время ветвь за ТЭ остается неизменной. В целом скачок уменьшается (рис. 9.14). Аналогично для оснований чем слабее титруемое основание, тем скачок меньше и тем более он смещен в кислую область. Для кислот и оснований с Л ветви кривой, т. е. скачок отсутствует. Так, нельзя оттитровать в водных растворах такие вещества, как Н3ВО3 [c.45]
Когда 1 мл 0,1 н. раствора сильной кислоты или основания добавляется к 1 л чистой воды, концентрация ионов водорода или гидроксила в воде изменяется приблизительно в 1000 раз. Если 1 л воды содержит 0,1 г-экв СН3СООН и 0,1 г-экв СНзСООЫа, то при добавлении НС это изменение едва заметно, так как ацетатная смесь является хорошим буфером. Буферы были определены Ван-Слайком [1] как вещества, присутствие которых в растворе увеличивает количество кислоты или щелочи, которые должны быть добавлены в раствор, чтобы вызвать изменение pH на единицу . Буферы позволяют точно регулировать концентрации ионов водорода и гидроксила и, следовательно, делают возможным контроль реакций, зависящих от степени кислотности. Буферное действие связано с наличием равновесия между водой, слабой кислотой (НА), основанием (В), амфоли-том (Z+) и ионами, в которые частично превращаются все эти вещества в водных растворах [c.94]
Буферы были определены Ван-Слайком [1] как вещества, присутствие которых в растворе увеличивает количество кислоты или щелочи, которые должны быть добавлены в раствор, чтобы вызвать изменение pH на единицу . Буферы позволяют точно регулировать концентрации ионов водорода и гидроксила и, следовательно, делают возможным контроль реакций, зависящих от степени кислотности. Буферное действие связано с наличием равновесия между водой, слабой кислотой (НА), основанием (В), амфоли-том (Z+) и ионами, в которые частично превращаются все эти вещества в водных растворах [c.94]
Количество, сильной кислоты, эквивалентное и противоположное по действию количеству сильного основания вызывает уменьшение pH. Поэтому отношение йЬ/й pH всегда йоложительно. Для оценки буферной емкости обычно суммируют добавляемые количества АЬ и, измеряя соответствующие значения pH находят АрН. Если величины АрН не очень велики, это приближение оказывается вполне удовлетворительным. [c.96]
Буферные системы, противодействие – Справочник химика 21
Способность буферной системы противодействовать смещению реакции среды измеряется буферной емкостью. Буферную емкость выражают количеством грамм-эквивалентов сильной кислоты или основания, которое следует добавить к литру буферного раствора, чтобы сместить pH на единицу [c.78]
Буферную емкость выражают количеством грамм-эквивалентов сильной кислоты или основания, которое следует добавить к литру буферного раствора, чтобы сместить pH на единицу [c.78]В животных и растительных организмах также действуют сложные буферные системы, поддерживающие постоянными pH крови, лимфы и других жидкостей. Буферными свойствами обладает и почва, которой свойственно противодействовать внешним факторам, изменяющим pH почвенного раствора, например при введении в почву кислот или оснований. [c.45]
Буферные растворы. Из рассмотрения кривых изменения pH при нейтрализации ясно, что существуют, некоторые растворы, добавление к которым небольших количеств кислоты или основания вызывает заметное изменение. pH, тогда -как в случае других растворов это изменение очень мало. Система последнего типа обыкновенно состоит из смеси приблизительно равных количеств сопряженных слабой кислоты и основания и называется буферным раствором.
 Противодействие раствора изменению концентрации ионов водорода при добавлении кислоты или щелочи известно под названием буферного действия. Величина буферного действия данного раствора определяется его буферной емкостью [9], которая измеряется количеством сильного основания, необходимого для изменения pH раствора на единицу [c.543]
Противодействие раствора изменению концентрации ионов водорода при добавлении кислоты или щелочи известно под названием буферного действия. Величина буферного действия данного раствора определяется его буферной емкостью [9], которая измеряется количеством сильного основания, необходимого для изменения pH раствора на единицу [c.543]Буферные системы обладают способностью противодействовать изменению pH при поступлении в ткани и биологические жидкости не только кислых, но и щелочных продуктов, например аммиака. Весьма важную роль при этом играет свободная углекислота, способная связывать ОН-ионы с образованием ионов бикарбоната [c.394]
Угольная кислота вместе с кислым углекислым натрием и калием образует так называемую буферную систему, которая с другими буферными системами крови обладает способностью противодействовать изменению концентрации водородных ионов при появлении в организме тех или иных свободных кислот или оснований. [c. 141]
141]
Когда создавались питательные смеси, методика измерения pH еще отсутствовала, но эмпирически в состав смесей подбирали соли в паре таким образом, чтобы влиянию физиологической реакции противодействовала соответствующая буферная система. [c.504]
Буферными называются растворы, обладающие определенным pH и способные поддерживать его почти неизменным при введении сильной кислоты или сильного основания. Такая способность системы противодействовать изменению pH называется буферным действием и количественно характеризуется буферной емкостью р. Буферная емкость измеряется количеством грамм-эквивалентов сильной кислоты или сильно-ного основания, изменяющим pH раствора на единицу. [c.154]
Из цифровых данных видно, что ацетатная смесь оказывает буферное действие только до тех пор, пока концентрация прибавленной кислоты или щелочи не превысит приблизительно 0,08 г-экв/л. Количество грамм-эквивалентов сильной кислоты или сильного основания, прибавление которого к ] л буферного раствора изменяет его pH на единицу, характеризует буферную емкость раствора. В организмах растений и животных также действуют сложные буферные системы, поддерживающие постоянными pH крови, лимфы и других жидкостей. Буферными свойствами обладает и почва, которой свойственно противодействовать внешним факторам, изменяющим pH почвенного раствора это имеет место, например, при введении в почву кислот или оснований. В анализе используют буферные растворы различного состава табл. 4). [c.32]
В организмах растений и животных также действуют сложные буферные системы, поддерживающие постоянными pH крови, лимфы и других жидкостей. Буферными свойствами обладает и почва, которой свойственно противодействовать внешним факторам, изменяющим pH почвенного раствора это имеет место, например, при введении в почву кислот или оснований. В анализе используют буферные растворы различного состава табл. 4). [c.32]
Кислотность и щелочность пищевых продуктов. Пищевые продукты содержат определенное количество кислот и щелочей, поэтому могут влиять на кислотно-щелочное равновесие в организме, смещая его в кислую или щелочную сторону. Буферные системы, находящиеся в организме, противодействуют этому. Однако возможности их ограничены, а при мышечной деятельности накапливаются кислые продукты метаболизма. Поэтому необходимо ограничивать поступление в организм кислых продуктов питания после интенсивных физических нагрузок, с тем чтобы предотвратить усиление закисления внутренней среды организма спортсмена.
 [c.446]
[c.446]Рис. 3.4 демонстрирует и другой важный момент. Рабочий участок буферной системы, т. е. способность противодействовать изменению pH при добавлении кислот и щелочей, имеет протяженность приблизительно одну единицу pH с каждой стороны от точки pH = р/Сд. Вне этого интервала буферная емкость быстро падает до 0. Интервал pH = рКа 1 называется зоной буферного действия. [c.114]
Смещение pH буферной системы зависит от количества прибавленной кислоты или щелочи. Количественной мерой способности буферных систем противодействовать изменению pH среды является буферная емкость. Буферную емкость вьфажают числом молей кислоты или щелочи, которое необходимо добавить к 1 литру буферного раствора для смещения pH раствора на единицу. [c.219]
Концентрация водородных ионов оказывает непосредственное влияние на биологические очистные системы, которые лучше всего работают в нейтральной среде. Аэрационные системы работают в диапазоне pH от 6,5 до 8,5. При pH более 8,5 микробная активность ингибируется, а при pH менее 6,5 метаболизм органических веществ, присутствующих в сточных водах, осуществляют в основном грибы. Обычно бикарбоиатно-буферная емкость сточной воды достаточна для противодействия росту кислотности и соответственно уменьшению значения pH, вместе с тем выработка микроорганизмами углекислого газа способстует регулированию щелочности сточной воды с высоким значением pH. Если при смешивании промышленных стоков с городскими сточными водами значение pH последних выходит за пределы оптимального диапазона, для их нейтрализации может потребоваться добавление химических соединений. В этом случае будет более правильным не искать способы контроля pH на городских очистных сооружениях, а требовать, чтобы промышленное предприятие до слива своих сточных вод в канализационную сеть предварительно проводт ло их обработку путем выравнивания состава и нейтрализации. [c.86]
При pH более 8,5 микробная активность ингибируется, а при pH менее 6,5 метаболизм органических веществ, присутствующих в сточных водах, осуществляют в основном грибы. Обычно бикарбоиатно-буферная емкость сточной воды достаточна для противодействия росту кислотности и соответственно уменьшению значения pH, вместе с тем выработка микроорганизмами углекислого газа способстует регулированию щелочности сточной воды с высоким значением pH. Если при смешивании промышленных стоков с городскими сточными водами значение pH последних выходит за пределы оптимального диапазона, для их нейтрализации может потребоваться добавление химических соединений. В этом случае будет более правильным не искать способы контроля pH на городских очистных сооружениях, а требовать, чтобы промышленное предприятие до слива своих сточных вод в канализационную сеть предварительно проводт ло их обработку путем выравнивания состава и нейтрализации. [c.86]
Скачок pH на кривой титрования в данном случае значительно меньше, чем в случае титрования НС1 этот скачок составляет всего 2,27 (от pH = 7,73 при 0,1-процентном избытке кислоты до pH = 10 при 0,1-процентном избытке щелочи). Это объясняется тем, что система СН3СООН — СНзСООМа, образующаяся в процессе титрования уксусной кислоты раствором едкого натра, обладает буферным действием, т. е. свойством противодействовать изменению pH при добавлении к ней небольшого количества щелочи. В случае кислот более слабых, чем уксусная, кривая титрования их щелочью идет еще отложе, без резких изменений в эквивалентной точке. Чем слабее титруемая кислота, тем при большем pH наступает момент эквивалентности. [c.211]
Это объясняется тем, что система СН3СООН — СНзСООМа, образующаяся в процессе титрования уксусной кислоты раствором едкого натра, обладает буферным действием, т. е. свойством противодействовать изменению pH при добавлении к ней небольшого количества щелочи. В случае кислот более слабых, чем уксусная, кривая титрования их щелочью идет еще отложе, без резких изменений в эквивалентной точке. Чем слабее титруемая кислота, тем при большем pH наступает момент эквивалентности. [c.211]
Насколько эффективным является противодействие буферных растворов изменению кислотности среды, видно при сравнении их с чистой водой. Действительно, если к 1 л чистой воды добавим 0,001 г-экв сильной кислоты или щелочи, то в первом случае получим [Н+]=10 з (рН = 3), а во втором [Н+]= = 10 , т. е. рН=11. Так как [Н+] чистой воды равно 10 , то, очевидно, кислотность чистой воды, являющейся, как говорят, незабуференной системой, изменится в 10 ООО раз. [c.83]
Измерение кислотосвязывающей способности ингредиентов, используемых в рационах свиней
21 января 2019 — Статья
Peadar G. Lawlor, P. Brendan Lynch, Patrick J. Caffrey, James J. O’Reilly and M. Karen O’Connell
Lawlor, P. Brendan Lynch, Patrick J. Caffrey, James J. O’Reilly and M. Karen O’Connell
Ветеринарный журнал Ирландии
Официальный журнал Ирландии в области ветеринарии, репрезентативный орган по ветеринарии для специалистов
2005 58:447
https://doi.org/10.1186/2046-0481-58-8-447 ©The Author(s) 2005
Опубликовано: 1 Августа 2005
Некоторые кормовые ингредиенты связывают в желудке больше кислоты, чем другие, и по этой причине их лучше всего исключать из кормов для свиней, если нужно повысить кислотность желудка. Целью данного исследования было измерить кислотосвязывающую способность (ABC) ингредиентов, обычно используемых в кормах для свиней. Ингредиенты были классифицированы следующим образом: (i) молочные продукты (n = 6), (ii) зерновые (n = 10), (iii) продукты из корнеплодов и мякоти (n = 5), (iv) растительные белки (n = 11) , (v) мясная и рыбная мука (n = 2), (vi) лекарственные препараты (n = 3), (vii) аминокислоты (n = 4), (viii) минеральные вещества (n = 16), (ix) соли кислот (n = 4), (x) кислоты (n = 10). Образец 0,5 г сырья суспендировали в 50 мл дистиллированной деионизированной воды при постоянном перемешивании. Эту суспензию титровали 0,1 моль/л HCl или 0,1 моль/л NaOH, так что для достижения рН 3,0 требовалось приблизительно 10 добавок титранта. Показания рН после каждого добавления записывали после уравновешивания в течение трех минут. Кислотосвязывающую способность ABC рассчитывали как количество кислоты в миллиэквивалентах (мэкв), необходимое для понижения pH 1 кг кормового сырья до (а) pH 4,0 (ABC-4) и (b) pH 3,0 (ABC-3). Категории кормового сырья имели статистически отличающиеся (P <0,01) значения ABC. Средние значения ABC-4 и ABC-3 для десяти категорий составляли: (i) 623 (SD 367.0) и 936 (SD. 460.2), (ii) 142 (SD 79.2) и 324 (SD 146,4), (iii) 368 (SD 65,3) и 804 (SD 126,7), (iv) 381 (SD 186,1) и 746 (SD 227,0), (V) 749 (SD 211,6) и 1508 (SD 360,8) , (VI) 120 (SD 95,6) и 261 (SD 163,2), (VII) 177 (SD 60,7) и 1078 (SD 359.0), (viii) 5064 (SD 5525.1) и 7051 (SD 5911.6), (ix) 5057 (SD 1336.
Образец 0,5 г сырья суспендировали в 50 мл дистиллированной деионизированной воды при постоянном перемешивании. Эту суспензию титровали 0,1 моль/л HCl или 0,1 моль/л NaOH, так что для достижения рН 3,0 требовалось приблизительно 10 добавок титранта. Показания рН после каждого добавления записывали после уравновешивания в течение трех минут. Кислотосвязывающую способность ABC рассчитывали как количество кислоты в миллиэквивалентах (мэкв), необходимое для понижения pH 1 кг кормового сырья до (а) pH 4,0 (ABC-4) и (b) pH 3,0 (ABC-3). Категории кормового сырья имели статистически отличающиеся (P <0,01) значения ABC. Средние значения ABC-4 и ABC-3 для десяти категорий составляли: (i) 623 (SD 367.0) и 936 (SD. 460.2), (ii) 142 (SD 79.2) и 324 (SD 146,4), (iii) 368 (SD 65,3) и 804 (SD 126,7), (iv) 381 (SD 186,1) и 746 (SD 227,0), (V) 749 (SD 211,6) и 1508 (SD 360,8) , (VI) 120 (SD 95,6) и 261 (SD 163,2), (VII) 177 (SD 60,7) и 1078 (SD 359.0), (viii) 5064 (SD 5525.1) и 7051 (SD 5911.6), (ix) 5057 (SD 1336.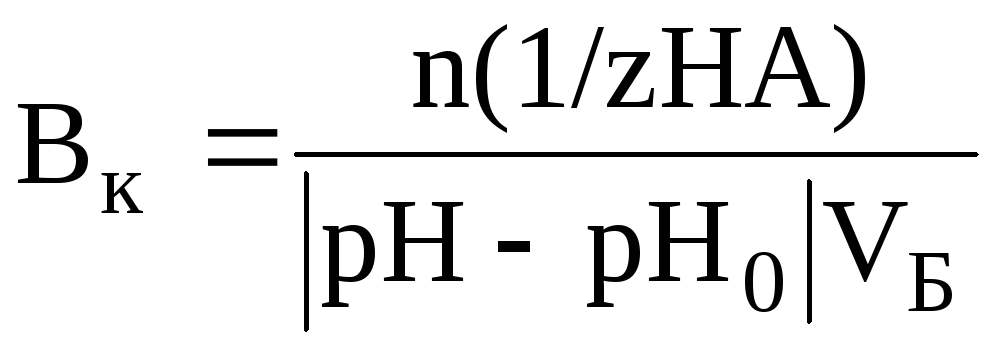 6) и 8945 (SD 2654.1) и (x) -5883 (SD 4220.5) и -2591 (SD 2245.4) мэкв HCl на кг соответственно. В пределах категории ABC-3 и ABC-4 значения были высоко коррелированными: значения R2 0,80 и более для категорий продуктов i, iv, v, vi, vii и viii. Корреляция между прогнозируемыми и наблюдаемыми значениями ABC для 34 комбикормов составляла 0,83 для ABC-4 и 0,71 для ABC-3. Был сделан вывод, что полнорационные корма с низкими значениями ABC могут быть сформулированы путем тщательного выбора ингредиентов. Конечный pH, до которого измеряется ABC, не должен иметь большого значения, поскольку ABC-3 и ABC-4 имеют высокую корреляцию.
6) и 8945 (SD 2654.1) и (x) -5883 (SD 4220.5) и -2591 (SD 2245.4) мэкв HCl на кг соответственно. В пределах категории ABC-3 и ABC-4 значения были высоко коррелированными: значения R2 0,80 и более для категорий продуктов i, iv, v, vi, vii и viii. Корреляция между прогнозируемыми и наблюдаемыми значениями ABC для 34 комбикормов составляла 0,83 для ABC-4 и 0,71 для ABC-3. Был сделан вывод, что полнорационные корма с низкими значениями ABC могут быть сформулированы путем тщательного выбора ингредиентов. Конечный pH, до которого измеряется ABC, не должен иметь большого значения, поскольку ABC-3 и ABC-4 имеют высокую корреляцию.
Вступление
У свиней переваривание белка начинается в желудке под действием пепсинов, которые выделяются слизистой оболочкой желудка также как и проферменты – пепсиногены. Превращение пепсиногена в пепсин происходит быстро при рН 2,0, но очень медленно при рН 5,0-6,0. В свою очередь, пепсины лучше всего работают в кислой среде, pH от 2,0 до 3,5, и активность быстро снижается выше этого pH. Углеводный гидролиз в желудке происходит под действием амилазы слюны, которая, в отличие от пепсина, инактивируется, когда pH падает до 3,5 [14, 18, 22].
Углеводный гидролиз в желудке происходит под действием амилазы слюны, которая, в отличие от пепсина, инактивируется, когда pH падает до 3,5 [14, 18, 22].
У поросят низкая секреция кислоты, и основным источником кислотности является бактериальная ферментация лактозы из молока свиноматок в молочную кислоту [9, 10, 14]. Высокий уровень лактата в желудке имеет тенденцию ингибировать секрецию соляной кислоты [10, 22]. Проедание твердой пищи снижает уровень молочной кислоты в желудке [22] и стимулирует выработку соляной кислоты [10, 7], но на практике потребление малышкового корма низкое и варьируется, по крайней мере, до возраста четырех недель [15].
В период отъема сочетание низкого уровня секреции кислоты, недостатка субстрата лактозы и потребления больших порций корма через нечастые промежутки времени может привести к повышению pH, часто до более чем 5,0, и уровень рН может оставаться высоким в течение нескольких дней [14]. Высокая кислотно-связывающая/буферная способность корма (его способность нейтрализовать кислоту) способствует дальнейшему повышению pH желудка [20, 13, 6]. Включение сыворотки или лактозы в стартовую диету обеспечивает продолжение бактериальной ферментации и некоторое, хотя и уменьшенное, производство молочной кислоты [14, 11]. Развитие способности секретировать соляную кислоту происходит быстрее у поросят-отъемышей, чем у поросят-сосунов [8].
Включение сыворотки или лактозы в стартовую диету обеспечивает продолжение бактериальной ферментации и некоторое, хотя и уменьшенное, производство молочной кислоты [14, 11]. Развитие способности секретировать соляную кислоту происходит быстрее у поросят-отъемышей, чем у поросят-сосунов [8].
Повышенный pH желудка после отъема приводит к снижению усвоения корма, который затем ферментируется в переднем отделе толстого кишечника и может спровоцировать диарею. Высокий рН в желудке также позволит патогенам выживать и даст им больше возможностей для колонизации пищеварительного тракта [6, 22].
Концепция манипулирования кислотностью желудка путем добавления кислоты в корма или использования кормов с низкой кислотосвязывающей или буферной способностью [20, 13, 6, 16, 17]существует уже давно, и добавление органических кислот в стартовый корм для поросят является обычной практикой. Тем не менее, имеется мало информации о кислотосвязывающей способности (ABC) ингредиентов, которые используются при составлении рецептов комбикормов.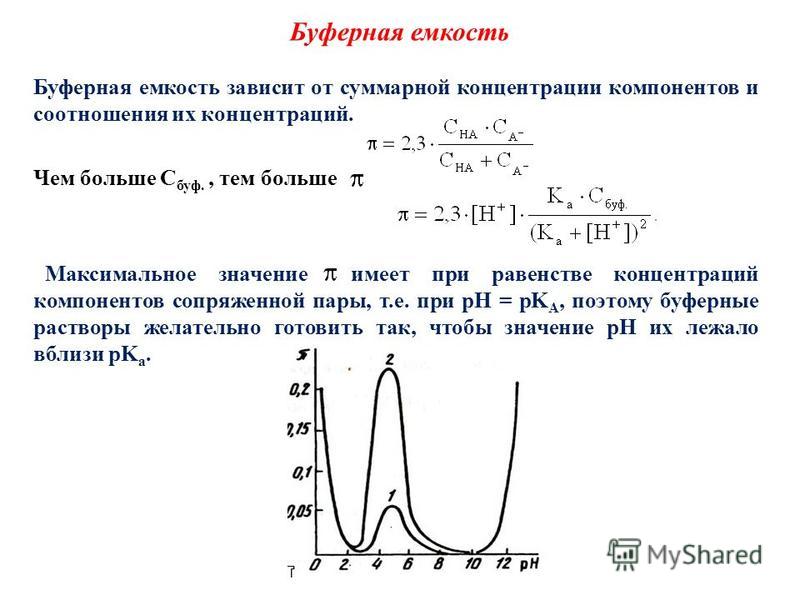 Ограниченные опубликованные данные были собраны с использованием методов с разными конечными точками титрования (например, pH = 3,0 или pH = 4,0), так что значения не сопоставимы [20, 13, 6, 12]. Целью данного исследования было найти значения ABC и буферной емкости отдельных кормовых ингредиентов и категорий ингредиентов и выяснить, существует ли корреляция между значениями ABC-3 и ABC-4. Еще одна цель состояла в том, чтобы исследовать возможность составления кормовых рационов с низким ABC для поросят-отъемышей, используя значения ABC для каждого ингредиента в матрице рецепта.
Ограниченные опубликованные данные были собраны с использованием методов с разными конечными точками титрования (например, pH = 3,0 или pH = 4,0), так что значения не сопоставимы [20, 13, 6, 12]. Целью данного исследования было найти значения ABC и буферной емкости отдельных кормовых ингредиентов и категорий ингредиентов и выяснить, существует ли корреляция между значениями ABC-3 и ABC-4. Еще одна цель состояла в том, чтобы исследовать возможность составления кормовых рационов с низким ABC для поросят-отъемышей, используя значения ABC для каждого ингредиента в матрице рецепта.
Материалы и методы
Процедуры
Ингредиенты, обычно используемые в рационах свиней, были получены в течение ряда лет из различных коммерческих источников в Ирландии. Все ингредиенты (в том виде, в котором они были получены) были размолоты через 2 мм сито с использованием лабораторной молотковой мельницы (Christy and Norris, Scunthorpe, UK) и хранились в герметичных банках при комнатной температуре до анализа. Измерения были завершены в течение одного месяца после получения каждого образца. Ингредиенты были сгруппированы по следующим категориям для простоты анализа: (i) молочные продукты, (ii) злаки, (iii) продукты из корнеплодов и мякоти, (iv) растительные белки, (v) мясная и рыбная мука, (vi) препараты, (vii) аминокислоты, (viii) минералы, (ix) соли кислот и (x) кислоты. Для определения pH и кислотосвязывающей способности (ABC) использовали модификацию метода Jasaitis et al. [13]. Данный метод использовал только pH = 4,0 в качестве конечной точки титрования, тогда как в настоящем исследовании использовались pH = 3,0, а также pH = 4,0 в качестве конечных точек титрования, чтобы обеспечить данные, более значимые для кормления свиней. Все измерения pH были выполнены с использованием лабораторного pH-метра (PHM 220, Radiometer, Copenhagen), который был откалиброван с использованием сертифицированных буферных растворов pH = 4,0 и pH = 7,0 (Radiometer, Copenhagen). Образец 0,5г ингредиента/сырья суспендировали в 50 мл дистиллированной и деионизированной воды и непрерывно перемешивали магнитной мешалкой.
Измерения были завершены в течение одного месяца после получения каждого образца. Ингредиенты были сгруппированы по следующим категориям для простоты анализа: (i) молочные продукты, (ii) злаки, (iii) продукты из корнеплодов и мякоти, (iv) растительные белки, (v) мясная и рыбная мука, (vi) препараты, (vii) аминокислоты, (viii) минералы, (ix) соли кислот и (x) кислоты. Для определения pH и кислотосвязывающей способности (ABC) использовали модификацию метода Jasaitis et al. [13]. Данный метод использовал только pH = 4,0 в качестве конечной точки титрования, тогда как в настоящем исследовании использовались pH = 3,0, а также pH = 4,0 в качестве конечных точек титрования, чтобы обеспечить данные, более значимые для кормления свиней. Все измерения pH были выполнены с использованием лабораторного pH-метра (PHM 220, Radiometer, Copenhagen), который был откалиброван с использованием сертифицированных буферных растворов pH = 4,0 и pH = 7,0 (Radiometer, Copenhagen). Образец 0,5г ингредиента/сырья суспендировали в 50 мл дистиллированной и деионизированной воды и непрерывно перемешивали магнитной мешалкой. Титрование осуществляли путем добавления кислоты (0,1N HCl) с различными приращениями (от 0,1 до 10 мл в зависимости от типа ингредиента и стадии титрования). Кислота добавлялась таким образом, что для достижения рН 3,0 требовалось приблизительно 10 отдельных добавлений кислоты. Начальное значение pH и все последующие показания, полученные во время титрования, регистрировали после уравновешивания в течение трех минут. ABC рассчитывали как количество кислоты в миллиэквивалентах (мэкв), необходимое для понижения рН 1 кг образца до (а) рН 4,0 (АВС-4) и (b) рН 3,0 (АВС-3). Буферную емкость (BUF) рассчитывали путем деления ABC на общее изменение единиц pH [от начального pH до конечного pH (а) 4,0 (BUF-4) и (b) 3,0 (BUF-3)]. BUF выражает количество кислоты, необходимое для получения изменения единиц pH кормового ингредиента/образца корма.
Титрование осуществляли путем добавления кислоты (0,1N HCl) с различными приращениями (от 0,1 до 10 мл в зависимости от типа ингредиента и стадии титрования). Кислота добавлялась таким образом, что для достижения рН 3,0 требовалось приблизительно 10 отдельных добавлений кислоты. Начальное значение pH и все последующие показания, полученные во время титрования, регистрировали после уравновешивания в течение трех минут. ABC рассчитывали как количество кислоты в миллиэквивалентах (мэкв), необходимое для понижения рН 1 кг образца до (а) рН 4,0 (АВС-4) и (b) рН 3,0 (АВС-3). Буферную емкость (BUF) рассчитывали путем деления ABC на общее изменение единиц pH [от начального pH до конечного pH (а) 4,0 (BUF-4) и (b) 3,0 (BUF-3)]. BUF выражает количество кислоты, необходимое для получения изменения единиц pH кормового ингредиента/образца корма.
Корма/ингредиенты с рН менее 3 или 4 титровали, как указано выше, но с 0,1 N NaOH до достижения рН 4,0 и/или рН 3,0. Значения ABC и BUF в этих случаях были отрицательными.
Статистический анализ
Средние значения и стандартное отклонение для каждого ингредиента рассчитывали для pH, ABC-4, ABC-3, BUF-4 и BUF-3. Уравнения регрессии (Proc Reg of Sas Inc., Cary, North Carolina) были установлены в отношении ABC-3 к ABC-4 для ингредиентов в каждой категории. Эту процедуру также использовали для установления взаимосвязи между прогнозируемыми и наблюдаемыми значениями ABC-4 и ABC-3 для 34 комбикормов свиней. Прогнозируемые значения были получены путем включения значений ABC-4 и ABC-3 каждого отдельного ингредиента в матрицу комбикорма.
Результаты
Средние значения ABC и BUF для каждого ингредиента показаны в Таблице 1. Средние значения ABC для каждой категории и корреляция между значениями ABC-3 и ABC-4 для каждой категории показаны в Таблице 2. Корреляция между прогнозируемыми и наблюдаемыми значениями ABC для 34 рационов отъема представлены в Таблице 3.
Таблица 1
pH, кислотосвязывающая способность (ABC) и буферная емкость (BUF) некоторых часто используемых кормовых ингредиентов (среднее значение ± s. d.)
d.)
| Ингредиенты | N1 | pH2 | ABC-43 | ABC-34 | BUF-45 | BUF-36 |
|---|---|---|---|---|---|---|
| Молочные ингредиенты | ||||||
| Кислотный казеин | 1 | 3.9 | 0 | 200 | 0 | 222 |
| Свиноматочное молоко | 2 |
8. 1 ± 0.04 1 ± 0.04
|
481 ± 1.0 | 650 ± 70.7 | 118 ± 0.8 | 128 ± 14.8 |
| Сухая сыворотка | 9 | 6.6 ± 0.31 | 434 ± 99.9 | 714 ± 149.3 | 168 ± 36.5 | 199 ± 39.9 |
| Заменитель молока | 4 | 6.7 ± 0.22 | 579 ± 54.6 | 892 ± 97.8 | 214 ± 38.1 |
240 ± 40. 6 6
|
| Обезжиренное молоко | 3 | 7.1 ± 0.20 | 756 ± 59.6 | 1105 ± 108.7 | 242 ± 29.4 | 268 ± 35.4 |
| Сычужный казеин | 3 | 8.1 ± 0.06 | 1423 ± 35.5 | 1929 ± 76.9 | 348 ± 4.0 | 379 ± 11.1 |
| Зерновые | ||||||
| Овсяные хлопья | 1 |
6. 7 7
|
72 | 180 | 27 | 49 |
| Пшеница | 12 | 6.9 ± 0.12 | 108 ± 14.9 | 194 ± 15.8 | 37 ± 5.0 | 50 ± 3.7 |
| Мелкая овсяная крупа | 1 | 5.5 | 81 | 239 | 56 | 97 |
| Ячменные отруби | 1 |
6. 7 7
|
104 | 240 | 39 | 65 |
| Кукурузный крахмал | 6 | 7.0 ± 0.78 | 91 ± 45.6 | 202 ± 58.5 | 29 ± 11.4 | 51 ± 13.5 |
| Кукуруза | 8 | 6.7 ± 0.24 | 111 ± 35.8 | 254 ± 53.1 | 41 ± 10.6 | 68 ± 11.1 |
| Ячмень | 14 |
6. 6 ± 0.18 6 ± 0.18
|
113 ± 14.3 | 266 ± 43.1 | 43 ± 3.6 | 73 ± 10.5 |
| Кукурузные хлопья | 1 | 7.6 | 240 | 424 | 67 | 92 |
| Кукурузная барда | 8 | 4.4 ± 0.17 | 96 ± 38.6 | 438 ± 42.9 | 262 ± 75.4 | 317 ± 56.3 |
| Пшеничные мелкие отруби | 12 |
6. 9 ± 0.29 9 ± 0.29
|
292 ± 20.6 | 572 ± 24.0 | 100 ± 12.1 | 146 ± 14.7 |
| Продукты из корнеплодов и мякоти | ||||||
| Сахар | 2 | 5.8 ± 0.06 | 23 ± 8.4 | 98 ± 11.8 | 13 ± 5.2 | 36 ± 3.5 |
| Маниока | 1 |
5. 5 5
|
167 | 393 | 110 | 156 |
| Свекловичный жом | 1 | 6.0 | 191 | 480 | 98 | 163 |
| Патока | 10 | 6.1 ± 0.08 | 399 ± 37.6 | 790 ± 45.5 | 190 ± 19.1 | 255 ± 16.9 |
| Цитрусовый жом | 13 |
6. 8 ± 0.08 8 ± 0.08
|
373 ± 25.4 | 873 ± 49.9 | 135 ± 8.1 | 232 ± 12.2 |
| Растительные протеины | ||||||
| Барда сорго | 1 | 4.1 | 14 | 276 | 174 | 256 |
| Бобы | 1 |
6. 8 8
|
275 | 473 | 98 | 125 |
| Пальмоядровая мука | 9 | 5.9 ± 0.10 | 250 ± 38.2 | 485 ± 51.5 | 132 ± 23.2 | 167 ± 20.2 |
| Горох | 10 | 6.8 ± 0.11 | 278 ± 24.0 | 515 ± 43.1 | 98 ± 9.8 | 134 ± 12.7 |
| Люпин | 1 |
6. 2 2
|
337 | 645 | 156 | 204 |
| Кукурузный глютен | 15 | 4.4 ± 0.07 | 114 ± 19.7 | 571 ± 79.4 | 334 ± 73.1 | 424 ± 71.4 |
| Полножирная соя | 10 | 6.9 ± 0.28 | 480 ± 43.5 | 823 ± 62.2 | 166 ± 13.9 | 212 ± 16.8 |
| Подсолнечниковый шрот | 11 |
6. 7 ± 0.19 7 ± 0.19
|
482 ± 52.7 | 852 ± 91.4 | 180 ± 14.7 | 231 ± 16.4 |
| Сойкомил | 1 | 7.5 | 622 | 959 | 180 | 216 |
| Рапсовый шрот | 12 | 6.3 ± 0.11 | 498 ± 49.3 | 945 ± 65.2 | 215 ± 20.5 | 284 ± 21.2 |
| Соевый шрот | 12 |
7. 1 ± 0.06 1 ± 0.06
|
642 ± 51.1 | 1068 ± 74.0 | 210 ± 18.0 | 263 ± 20.2 |
| Мясная и рыбная мука | ||||||
| Мясокостная мука | 1 | 6.6 | 595 | 920 | 214 | 243 |
| Рыбная мука | 10 |
6. 7 ± 0.37 7 ± 0.37
|
738 ± 219.3 | 1457 ± 334.5 | 285 ± 96.8 | 404 ± 105.9 |
| Жир | ||||||
| Жир | 1 | 4.9 | 16 | 137 | 17 | 72 |
| Смесь жиров | 1 |
6. 6 6
|
363 | 609 | 138 | 168 |
| Препараты | ||||||
| Spiratet | 1 | 5.6 | 114 | 340 | 73 | 133 |
| Холин хлорид | 12 |
6. 7 ± 0.52 7 ± 0.52
|
101 ± 68.6 | 226 ± 136.0 | 37 ± 23.5 | 61 ± 35.8 |
| Tylamix (прим.пер. – тилозин) | 1 | 7.0 | 370 | 610 | 123 | 152 |
| Микробильный протеин | ||||||
| Дрожжи | 1 |
3. 4 4
|
150 | 130 | -250 | 325 |
| Аминокислоты | ||||||
| Лизин | 11 | 6.5 ± 0.38 | 123 ± 23.3 | 695 ± 124.3 | 50 ± 6.0 | 200 ± 22.5 |
| Триптофан | 8 |
7. 0 ± 0.23 0 ± 0.23
|
179 ± 17.1 | 1024 ± 90.8 | 60 ± 4.6 | 258 ± 25.4 |
| Метионин | 9 | 6.5 ± 0.34 | 192 ± 75.9 | 1219 ± 267.0 | 77 ± 23.0 | 349 ± 52.5 |
| Треонин | 11 | 6.5 ± 0.22 | 218 ± 57.6 | 1386 ± 354.2 | 86 ± 17.2 | 391 ± 83.4 |
| Минералы | ||||||
| Сульфат железа | 3 |
3. 2 ± 0.09 2 ± 0.09
|
-655 ± 18.1 | 93 ± 53.2 | -821 ± 77.3 | 456 ± 96.2 |
| Соль | 6 | 7.5 ± 0.18 | 83 ± 21.5 | 162 ± 37.5 | 24 ± 6.8 | 36 ± 9.1 |
| Сульфат меди | 3 | 5.1 ± 0.06 | 92 ± 3.3 | 269 ± 9.2 | 80 ± 7.1 | 125 ± 0.6 |
| Сульфат кобальта | 3 |
7. 4 ± 0.04 4 ± 0.04
|
329 ± 6.5 | 516 ± 9.7 | 97 ± 3.0 | 117 ± 1.5 |
| Моноаммоний фосфат | 3 | 4.2 ± 0.05 | 46 ± 10.5 | 815 ± 40.1 | 247 ± 13.2 | 687 ± 33.8 |
| Оксид железа | 3 | 8.7 ± 0.16 | 549 ± 78.5 | 986 ± 78.6 | 117 ± 15.8 | 173 ± 12.5 |
| Финишные минералы и витамины | 3 |
5. 2 ± 0.04 2 ± 0.04
|
3357 ± 305.5 | 5123 ± 303.9 | 2772 ± 194.7 | 2317 ± 104.8 |
| Минералы и витамины на отъеме | 3 | 5.2 ± 0.03 | 4292 ± 1008.9 | 6302 ± 1054.0 | 3472 ± 765.1 | 2819 ± 448.8 |
| Дикальция фосфат | 5 | 7.6 ± 0.19 | 3098 ± 1028.5 | 5666 ± 1852.4 | 857 ± 293.7 |
1234 ± 431. 2 2
|
| Минералы и витамины для свиноматок | 3 | 5.3 ± 0.05 | 5413 ± 216.4 | 7503 ± 132.3 | 4182 ± 300.5 | 3268 ± 117.1 |
| Цитрат калия | 3 | 8.6 ± 0.07 | 5703 ± 1.6 | 7851 ± 13.6 | 1251 ± 19.0 | 1412 ± 19.1 |
| Монодикальция фосфат | 9 | 4.4 ± 0.26 |
291 ± 159. 5 5
|
5494 ± 2574.3 | 1302 ± 980.8 | 4400 ± 2564.3 |
| Цитрат натрия | 3 | 8.4 ± 0.19 | 6334 ± 13.6 | 8745 ± 20.5 | 1449 ± 66.9 | 1628 ± 58.6 |
| Кальцинированный фосфат | 3 | 9.9 ± 0.09 | 6412 ± 1032.9 | 10436 ± 337.5 | 1085 ± 161.0 | 1511 ± 28.9 |
| Формиат кальция | 3 |
7. 4 ± 0.15 4 ± 0.15
|
3983 ± 97.9 | 12069 ± 409.7 | 1182 ± 29.6 | 2760 ± 18.3 |
| Оксид марганца | 3 | 8.8 ± 0.07 | 6678 ± 1045.7 | 10887 ± 2264.6 | 1400 ± 210.9 | 1887 ± 381.9 |
| Бикарбонат натрия | 3 | 8.7 ± 0.44 | 12566 ± 554.1 | 12870 ± 399.1 | 2706 ± 147.4 | 2280 ± 110.3 |
| Известняковая мука | 13 | 8.9 ± 0.46 | 12932 ± 21883 | 15044 ± 2125.4 | 2661 ± 479.8 | 2565 ± 380.6 |
| Оксид цинка | 3 | 8.3 ± 0.19 | 16321 ± 11701 | 17908 ± 1100.9 | 3768 ± 193.0 | 3363 ± 238.0 |
| Кислоты | ||||||
| Ортофосфорная кислота | 3 | 1.6 ± 0.02 | -8858 ± 168.2 | -7957 ± 204.5 | -3665 ± 54.5 | -5616 ± 97.4 |
| Фумаровая кислота | 3 | 2.3 ± 0.06 | -10862 ± 469.6 | -4093 ± 669.7 | -6314 ± 54.6 | -5659 ± 478.7 |
| Муравьиная кислота | 3 | 2.3 ± 0.03 | -13550 ± 765.0 | -3473 ± 110.3 | -7824 ± 572.9 | -4745 ± 344.7 |
| Лимонная кислота | 5 | 2.2 ± 0.03 | -5605 ± 202.2 | -2349 ± 164.3 | -3156 ± 89.9 | -3024 ± 97.5 |
| Аскорбиновая кислота | 3 | 2.8 ± 0.03 | -217 ± 28.6 | -2249 ± 77.0 | -177 ± 19.4 | -10159 ± 1048.2 |
| Яблочная кислота | 3 | 2.2 ± 0.15 | -7214 ± 694.6 | -2550 ± 769.0 | -4084 ± 575.8 | -3242 ± 333.0 |
| Молочная кислота | 3 | 2.4 ± 0.02 | -5079 ± 53.9 | -1498 ± 23.7 | -3129 ± 63.0 | -2405 ± 111.3 |
| Уксусная кислота | 3 | 2.9 ± 0.02 | -2283 ± 104.1 | -141 ± 24.9 | -2011 ± 133.1 | -1031 ± 33.6 |
| Пропионовая кислота | 3 | 3.0 ± 0.01 | -1358 ± 276.5 | -5 ± 8.2 | -1348 ± 259.6 | -238 ± 412.4 |
| Сорбиновая кислота | 1 | 3.5 | -220 | 120 | -400 | 267 |
1Число образцов. 2Начальный pH образца. 3Кислотосвязывающая способность до pH 4.0. 4 Кислотосвязывающая способность до pH 3.0. 5Буферная емкость до pH 4.0. 6 Буферная емкость до pH 3.0
Таблица 2
Модели прогнозирования кислотосвязывающей способности до pH 3,0 (ABC-3) от кислотосвязывающей способности до pH 4,0 (ABC-4) для различных видом кормового сырья
| Вид кормового сырья | N1 | ABC-4 | ABC-3 | Y2 | A3 | B4 | (R2)5 | (Adj.R2)6 | RSD7 |
|---|---|---|---|---|---|---|---|---|---|
| Молочные продукты | 22 | 623 ± 367.0 | 936 ± 460.2 | ABC-4 | -118.45*** | 0.79*** | 0.99 | 0.99 | 39.55 |
| Зерновые | 64 | 142 ± 79.2 | 324 ± 146.4 | ABC-4 | -2.34 | 0.45*** | 0.68 | 0.67 | 45.41 |
| Продукты из корнеплодов и мякоти | 27 | 368 ± 65.3 | 804.7 ± 126.7 | ABC-4 | 14.50 | 0.44*** | 0.73 | 0.72 | 34.75 |
| Растительные протеины | 84 | 380.7 ± 186.1 | 746 ± 227.0 | ABC-4 | -177.57*** | 0.75*** | 0.83 | 0.83 | 76.49 |
| Мясная и рыбная мука | 11 | 749 ± 211.6 | 1508 ± 360.8 | ABC-4 | -56.66 | 0.53*** | 0.83 | 0.81 | 91.75 |
| Препараты | 14 | 120 ± 95.6 | 261 ± 163.2 | ABC-4 | -26.55+ | 0.56*** | 0.92 | 0.91 | 27.52 |
| Аминокислоты | 39 | 177 ± 60.7 | 1078 ± 359.0 | ABC-4 | 7.40 | 0.16*** | 0.87 | 0.86 | 22.51 |
| Минералы | 73 | 5064 ± 5525.1 | 7051 ± 5911.6 | ABC-4 | -1157.30*** | 0.88*** | 0.89 | 0.89 | 1833.53 |
| Соли кислот | 10 | 5057 ± 1336.6 | 8945 ± 2654 | ABC-4 | 4909.16* | 0.02 | 0.01 | -0.12 | 1416.90 |
| Кислоты | 30 | -5883 ± 4220.5 | -2591 ± 2245.4 | ABC-4 | -2771.41** | 1.20*** | 0.41 | 0.39 | 3304.56 |
1Число образцов. 2Зависимая переменная. 3Коэффициент регрессии. 4Коэффициент регрессии для регрессии на ABC-3. 5 Коэффициент детерминации. 6Скорректированный R2. 7Остаточное стандартное отклонение.
Таблица 3
Модели для прогнозирования наблюдаемой кислотосвязывающей способности до pH 4,0 (ABC-4) и наблюдаемой кислотосвязывающей способности до pH 3,0 (ABC-3) от их соответствующих прогнозируемых значений ABC
| Показатель | N1 | Фактическое значение | Прогнозируемое значение | Y2 | A3 | B4 | (R2)5 | (Adj. R2)6 | RSD7 |
|---|---|---|---|---|---|---|---|---|---|
| ABC-4 | 34 | 259 ± 93.3 | 294 ± 124.8 | Фактическое ABC-4 | 59.50** | 0.68*** | 0.83 | 0.82 | 39.11 |
| ABC-3 | 34 | 608 ± 88.8 | 640 ± 77.6 | Фактическое ABC-3 | -9.32 | 0.97*** | 0.71 | 0.70 | 48.28 |
1Число образцов. 2Зависимая переменная. 3Коэффициент регрессии. 4Коэффициент регрессии для регрессии на прогнозируемые АВС-4 или ABC-3. 5Коэффициент детерминации. 6Скорректированный R2. 7Остаточное стандартное отклонение.
Начальный pH, ABC-4 и ABC-3 значительно варьировались между отдельными ингредиентами. Категории ингредиентов были статистически различны (P <0,01) в отношении значений ABC и BUF, но также были обнаружены большие различия в категориях ингредиентов по исходному pH, ABC и BUF.
Соли кислот и минералы были категориями, которые имели самые высокие значения ABC и BUF. Большие различия наблюдались между различными типами минералов. Оксид цинка, известняковая мука и бикарбонат натрия имели самые высокие значения ABC. Из источников фосфора дефторированный фосфат имел самые высокие значения ABC, дикальцийфосфат и монокальцийфосфат имели промежуточные значения, в то время как моноаммонийфосфат имел самые низкие значения. Мясная и рыбная мука, молочные продукты, аминокислоты, продукты из корнеплодов и мякоти и растительные белки были категориями органических ингредиентов с самыми высокими значениями ABC и BUF. Зерновые имели самые низкие значения в категории органических ингредиентов. Из ингредиентов, как неорганических, так и органических, категория кислот имела самые низкие значения ABC и BUF. Большинство значений ABC для отдельных кислот были отрицательными, причем ортофосфорная, фумаровая, муравьиная, яблочная и лимонная кислоты имели самые отрицательные значения.
Средние значения ABC-3 и ABC-4 для ингредиентов внутри категорий хорошо коррелируют. Значения R2 0,90 или выше были определены для молочных продуктов и лекарственных препаратов. Значения R2 от 0,85 до 0,90 были определены для аминокислот и минералов. Как растительные белки, так и мясо и рыбная мука имели значения R2 от 0,80 до 0,85.
Значения ABC для стартовых рационов свиней были предсказаны исходя из среднего значения ABC (Таблица 1) каждого ингредиента в их составе и их количества в рационе. Корреляция между предсказанными и наблюдаемыми значениями ABC была относительно хорошей. Для ABC-4 R2 был 0,83, а для ABC-3 R2 был 0,71.Обсуждение
Некоторые ингредиенты связывают больше кислоты в желудке, чем другие, и по этой причине их использование в рационах свиней может привести к повышению желудочного рН. Высокий рН в желудке вреден для свиней, поскольку он способствует пролиферации вредных микроорганизмов [6] и подавляет переваривание белка [14, 18, 22].
В настоящем исследовании был рассмотрен ряд ингредиентов, которые обычно используются в рационах свиней. Предполагалось, что будут определены ингредиенты с низким ABC, которые затем можно будет использовать для составления стартового рациона таким образом, чтобы повысить кислотность желудка. Jasaitis et al. [13] обнаружили, что минеральные добавки имели более высокие значения ABC-4 и BUF-4, чем органические ингредиенты. В настоящем эксперименте минералы как категория ингредиентов имели вторые по величине значения ABC и BUF среди всех исследованных категорий. Было обнаружено, что соли кислот имели самые высокие значения. Jasaitis et al. [13] обнаружили, что карбонаты и двухосновные или трехосновные минеральные добавки имели самые высокие значения ABC и BUF. За исключением микроэлементов оксида цинка и оксида марганца, настоящий эксперимент согласуется с этим выводом. Известняковая мука и бикарбонат натрия имели самые высокие значения ABC, причем минералы с дефторированными фосфатами, дикальций фосфатом и монодикальций фосфатом являются следующими по величине. Болдуан [5] обнаружил, что увеличение минеральных добавок в рационе с 0 до 4% утроило значение ABC-4. По этой причине Bolduan et al. [6] и Bolduan [5] предложили ограничить содержание минералов в стартовом рационе в течение короткого периода после отъема. Было высказано предположение, что эта практика принесет пользу свиньям с точки зрения здоровья. Однако это может в некоторой степени замедлить рост, так как потребность в минералах для формирования костей не будет обеспечена [5], особенно если период ограниченного кормления минералами продлен.
Что касается органических ингредиентов, то их значения ABC положительно коррелируют с содержанием золы и белка [13, 6, 5]. Prohaszka и Baron [20] также обнаружили, что ABC-3 корма увеличивается с увеличением содержания белка. В настоящем эксперименте мясная и рыбная мука имели самые высокие значения ABC и BUF среди всех органических ингредиентов. Считалось, что это из-за их высокого содержания золы и белка. Jasaitis et al. [13] также обнаружили, что эти ингредиенты имеют самые высокие значения ABC-4 среди всех органических ингредиентов. Категория молочных продуктов (в частности, сычужный казеин и сухая обезжиренная сыворотка) также имела высокие значения ABC. Тем не менее, другие ингредиенты в этой категории имели более низкие значения. Опять же, считается, что это связано с содержанием золы и белка.
Из растительных белков самые высокие значения ABC имели соевый шрот, Сойкомил, рапс и шрот подсолнечника. Jasaitis et al. [13] обнаружили, что географическое происхождение ингредиента может влиять на его ABC, потому что оно влияет на концентрацию ионов в ингредиенте, и это может помочь объяснить изменение значений ABC, найденных для отдельных ингредиентов. Кукурузный глютен и барда сорго отличались от других ингредиентов группы растительных белковых, так как они имели значения pH менее 4,5, а их значения ABC были низкими по сравнению с другими ингредиентами в этой группе. Jasaitis et al. [13] также обнаружили, что такие ферментированные продукты имеют одни из самых низких значений ABC-4 среди исследованных органических ингредиентов.
Зерновые и некоторые продукты корнеплодов и мякоти имели низкие значения ABC и BUF в данном эксперименте. Это было в согласии с предыдущими выводами ([13, 5, 6] и [3]).
Было обнаружено, что кислоты имеют отрицательные значения ABC. Использование органических кислот в стартовых рационах дает возможность снизить ABC рациона без необходимости снижения содержания белка или минеральных веществ в рационе. Тем не менее, благотворное влияние органических кислот на здоровье свиней сильно зависит от первоначального значения BUF рациона [4]. Для снижения ABC рациона и повышения кислотности желудка подходящими стоит считать ортофосфорную, фумаровую, муравьиную или яблочную кислоты. Тем не менее, кислоты для использования в рационах свиней часто выбирают и из-за других качеств, таких как: антимикробное воздействие на патогенные бактерии, стимулирование полезных или пробиотических бактерий, питательная ценность, улучшение неспецифического иммунитета [19], стимулирующее действие на секрецию поджелудочной железы (например, молочная кислота: [21]), физическая форма (сухая или жидкая), коррозионные свойства и безопасность.
В литературе значения ABC-3 использовались некоторыми исследователями [20], в то время как значения ABC-4 использовались другими [13, 6]. Настоящее исследование показало, что эти значения для ингредиентов хорошо коррелируют в категориях ингредиентов, за исключением кислот и солей кислот. По этой причине важно, какая мера используется. Большие различия были отмечены в категориях ингредиентов в отношении значений ABC и BUF.
Значения ABC для комбикорма могут быть предсказаны, если известны ABC значения каждого ингредиента в рационе. Наблюдаемые и прогнозируемые значения ABC хорошо коррелировали. Jasaitis et al. [13] также обнаружили, что это так. Результатом является то, что рационы могут быть составлены с использованием значений ABC для ингредиентов, представленных здесь, так что создаются полные рационы с низкими значениями ABC. Такие рационы могут быть использованы, когда высокий рН в желудке может быть проблемой (например, при отъеме). Эти рационы также могут быть использованы как часть стратегии по сокращению кишечной палочки или сальмонеллы у более взрослых свиней. Это особенно важно в настоящее время из-за недавнего запрета ЕС на кормовые антибиотики в ответ на опасения человека в отношении устойчивых к антибиотикам бактерий, возникающих у животных [2, 1].
Признательность
Авторы выражают признательность аспирантам и студентам, в выполнении титрования, указанного здесь. Мы благодарны за предоставление образцов ингредиентов компаниями Glanbia, Portlaoise и Dairygold, Mitchelstown.
Список литературы
- Bager F, Aarestrup FM, Wegener HC: Dealing with antimicrobial resistance – the Danish experience. Canadian Journal of Animal Science. 2000, 80: 223-228. 10.4141/A99-096.
- Barton MD: Antibiotic use in animal feed and its impact on human health. Nutrition Research Reviews. 2000, 13: 279-299. 10.1079/095442200108729106.
- BASF: The acid-binding capacity of piglets. Info-Service Animal Nutrition. 1989, BASF Aktiengesellschaft, D-6700, Ludwigshafen
- Blank R, Sauer WC, Mosenthin R, Zentek J, Huang S, Roth S: Effect of fumaric acid supplementation and dietary buffering capacity on the concentration of microbial metabolites in ileal digesta of young pigs. Canadian Journal of Animal Science. 2001, 81: 345-353.
- Bolduan G: The regulation of the intestinal flora in piglets and sows – a new feeding strategy. From Research and Practical Experience No. 23. 1988, Ludwigshafen: BASF, 1-17.
- Bolduan G, Jung H, Schnabel E, Schneider R: Recent advances in the nutrition of weaner pigs. Pig News and Information. 1988, 9: 381-385.
- Cranwell PD: The development of acid and pepsin secretory capacity in the pig. The effects of age and weaning. 1. Studies in anaesthetized pigs. British Journal of Nutrition. 1985, 54: 305-320. 10.1079/BJN19850113.
- Cranwell PD, Moughan PJ: Biological limitations imposed by the digestive system to the growth performance of weaned pigs. Manipulating Pig Production 11. Edited by: Barnett JL, Hennessy DP. 1989, Werribee, Victoria, Australia: Australian Pig Science Association, 140-159.
- Cranwell PD, Noakes DE, Hill KJ: Observations on the stomach content of the suckling pig. Proceedings of the Nutrition Society. 1968, 27: 26A .
- Cranwell PD, Noakes DE, Hill KJ: Gastric secretion and fermentation in the suckling pig. British Journal of Nutrition. 1976, 36: 71-86. 10.1079/BJN19760059.
- Easter RA: Acidification of diets for pigs. Recent Advances in Animal Nutrition. Edited by: Cole DJA, Haresign W. 1988, London: Butterworths, 61-71.
- Giger-Reverdin S, Duvaux-Ponter C, Sauvant D, Martin O, Nunes do Prado I, Miller R: Intrinsic buffering capacity of feedstuffs. Animal Feed Science and Technology. 2002, 96: 83-102. 10.1016/S0377-8401(01)00330-3.
- Jasaitis DK, Wohlt JE, Evans JL: Influence of feed-ion content on buffering capacity of ruminant feedstuffs in vitro. Journal of Dairy Science. 1987, 70: 1391-1403. 10.3168/jds.S0022-0302(87)80161-3.
- Kidder DE, Manners MJ: Digestion in the Pig. 1978, Bristol: Scientechnica
- Lawlor PG, Lynch PB, Caffrey PJ, O’ Doherty JV: Effect of pre- and post-weaning management on subsequent pig performance to slaughter and carcass quality. Animal Science. 2000, 75: 245-256.
- Lawlor PG, Lynch PB, Caffrey PJ: Effect of creep feeding, dietary fumaric acid and level of dairy product in the diet on post-weaning pig performance. 2005
- Lawlor PG, Lynch PB, Caffrey PJ: Comparison of fumaric acid, calcium formate and mineral levels in diets for newly weaned pigs. Irish Journal of Agricultural and Food Research. 2005, (unpublished data)
- Longland AC: Digestive enzyme activities in pigs and poultry. In vitro Digestion for Pigs and Poultry. Edited by: Fuller MF. 1991, Wallingford, U.K: CAB International, 3-18.
- Pratt VC, Tappenden KA, McBurney MI, Field CJ: Short chain fatty acid-supplemented total parenteral nutrition improves nonspecific immunity after intestinal resection in rats. Journal of Parenteral and Enteral Nutrition. 1996, 20: 264-271. 10.1177/0148607196020004264.
- Prohaszka L, Baron F: The predisposing role of high dietary protein supplies in enteropathogenic E. coli infections of weaned pigs. Zentralblatt für Veterinärmedicin. 1980, 27: 222-232.
- Thaela MJ, Jensen MS, Pierzynowski SG, Jakob S, Jensen BB: Effect of lactic acid supplementation on pancreatic secretion in pigs after weaning. Journal of Animal and Feed Sciences. 1998, 7 (supplement 1): 181-183.
- Yen JT: Anatomy of the digestive system and nutritional physiology. Swine Nutrition. Edited by: Lewis AJ, Southern LL. 2001, Boca Raton: CRC Press, 31-63. Second
Буферные системы организма. Кислотно-основное состояние крови
Химия Буферные системы организма. Кислотно-основное состояние крови
просмотров – 397
Буферная емкость.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, принято называть буферной емкостью.
Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет рН на единицу.
В=C·V/∆pH·Vбуф,
где В – буферная емкость,
С – концентрация кислоты или основания,
V – объем данного электролита͵
Vбуф – объем буферного раствора ,
∆pH – изменение рН.
Буферная емкость зависит от ряда факторов:
1. Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость.
2. Буферная емкость зависит от отношения концентраций компонентов , а следовательно , и от рН буфера. При рН=рКа буферная емкость максимальна.
3. Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз.
Интервал рН=рКа±1 принято называть зоной буферного действия.
4. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
Пример: Рассчитайте ёмкость буферного раствора по кислоте, если при добавлении к 50мл этого раствора 2мл HCl рН изменился от 7,3 до 7,0.
Образец решения: Используем формулу:
Организм человека владеет специальным механизмом координации физиологических и биохимических процессов и может поддерживать на определенном уровне содержание разных веществ, а именно: газов, воды, электролитов, ионов металлов и Водорода, биолигандов. Эта координация по предложению К. Кеннона была названная гомеостазом. Важной составляющей этого процесса является поддержание определенного значения рН среды биожидкости, достигаемое с помощью физиологических и физико-химических механизмов. Физиологические системы регулирования рH связаны с работой легких, почек и рассматриваются в курсе физиологии.
Под физико-химическим механизмом понимают действие буферных систем. Οʜᴎ предоставляют возможность организма, как открытой термодинамической системе реализовать принцип Ле Шателье, ᴛ.ᴇ. активно противодействовать влиянию внешних факторов, направленных на смену кислотности его физиологических жидкостей – крови, желчи, мочи, секретов внутренних желез.
Буферные системы организма – это, прежде всего, гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Все эти системы имеются в крови, где с их помощью особенно строго поддерживается рН=7,4±0,05, несмотря на поступление в кровь из кишечника и тканей значительного количества кислот и небольшого- оснований.
Гидрокарбонатная буферная система состоит из угольной кислоты (донор протона) и сопряженного основания (акцептор протона) в растворе .
Ее особенность в том, что один из компонентов- угольная кислота образуется при взаимодействии растворенного в плазме СО2 с водой. Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
Угольная кислота при физиологическом значении рН=7,4 находится преимущественно в виде , а отношение компонентов буферной системы крови = 20:1. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, главное назначение гидрокарбонатного буфера заключается в нейтрализации кислот:
Нейтрализация оснований:
Гидрокарбонатная буферная система является системой быстрого эффективного реагирования, т.к. продукт ее взаимодействия с кислотами- углекислый газ- быстро выводится через легкие. Нарушение кислотно- основного равновесия в организме компенсируется прежде всего гидрокарбонатным буфером (за 10–15 минут).
Гидрокарбонатный буфер обеспечивает около 55% от всей буферной емкости крови. Он содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера имеет вид:
Согласно цепочке равновесий содержание Н2СО3 определяется концентрацией растворенного СО2 , которая по закону Генри пропорциональна давлению СО2 в газовой фазе. В конечном счете оказывается, что [H2CO3] пропорциональна р(СО2 ) и уравнение Гендерсона-Гассельбаха с учетом этого принимает вид:
Фосфатная буферная система содержится в крови и клеточной жидкости других тканей, особенно почек. В клетках она представлена и , а в плазме крови и межклеточной жидкости и. Роль донора протона в этой системе играет ион , а акцептора протона – ион . Из уравнения Гендерсона-Гассельбаха для фосфатной буферной системы
следует, что при значении рНкрови=7,4 отношение . Следовательно, и эта система имеет буферную емкость по кислоте больше, чем по основанию. При накоплении катионов Н+ во внутриклеточной жидкости, к примеру, после приема мясной пищи происходит их нейтрализация ионами :
(выводится почками, моча кислая, рН≈4,8)
При увеличении концентрации оснований в организме, к примеру при употреблении растительной пищи, они нейтрализуются ионами :
(удаляется почками, моча щелочная, рН≈7,5)
Фосфатная буферная система более «консервативна», чем гидрокарбонатная, т.к. фосфатная система работает преимущественно с почками, а гидрокарбонатная с легкими. Длительность восстановления отношения до нормы составляет 2-3 суток, а для – 10-18 часов. Этот факт крайне важно учитывать при терапевтической коррекции нарушений кислотно-основного равновесия организма.
Белковые буферные системы бывают анионного (основного) и катионного (кислотного) типов, в зависимости от кислотно-базовых свойств белка, которые характеризуются его изоэлектрической точкой (рI). Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде (рI=4,9-6,3). При рН>рI эти белки существуют в анионной форме, а при рН<рI – катионной.
Анионный белковый буфер работает в крови (рН>6). Он состоит из белка-основания (анионная форма белка ― акцептор Н+ ) и сопряженной кислоты (диполярный ион ― донор Н+):
белок-основание (В) белок-соль ― сопряженная кислота()
Механизм действия:
Катионная белковая буферная система обычно поддерживает величину рН в физиологических средах с рН<6. Она состоит из белка-кислоты (катион белка-донор Н+) и сопряженного основания (диполярный ион ― акцептор Н+):
белок-кислота(НА) белок-соль ― сопряженное основание ()
Механизм действия:
Гемоглобиновая и оксигемоглобиноваябуферные системы ― мощные системы эритроцитов. В качестве донора выступают две слабые кислоты: гемоглобин и оксигемоглобин . Роль акцептора выполняют сопряженные этим кислотам основания, ᴛ.ᴇ. их анионы и .
Механизм буферного действия гемоглобиновых систем основан на следующих реакциях:
.
(нейтрализация кислот) (нейтрализация оснований)
Гемоглобиновые системы крови эффективно функционируют только в сочетании с другими буферными системами крови.
Назван опасный побочный эффект зубных антибактериальных ополаскивателей
Медики из Плимутского университета выявили негативные последствия, к которым может привести частое применение ополаскивателей для полости рта на основе хлоргексидина.
Исследователи провели эксперимент, участники которого использовали жидкость в течение семи дней, а затем проходили анализ микробиома ротовой полости. В частности, измерялся уровень pH, буферная емкость слюны (уровень нейтрализации кислоты и щелочи), степень концентрации молочной кислоты, глюкозы, нитратов и нитритов.
Результаты продемонстрировали неожиданный результат. Применение ополаскивателя привело к уменьшению количества бактерий, отвечающих за нормальную микрофлору верхних дыхательных путей и желудочно-кишечного тракта (Bacteroidetes, TM7, Fusobacteria). На этом фоне повысилось число патогенных и условно-патогенных микроорганизмов (Firmicutes, Proteobacteria).
– Изменение было связано с повышением кислотности, так как хлоргексидин уменьшает микробное разнообразие. Поддержание нейтрального уровня pH в ротовой полости является одной из основных функций слюны. Слишком низкий pH может привести не только к повреждению зубов, но и слизистой оболочки всей полости рта, – пояснил ведущий автор исследования доктор Рауль Бескос.
Кроме того, эксперимент показал, что популярный антисептик нарушает способность бактерий превращать нитрат в нитрит – ключевую молекулу для снижения кровяного давления. У участников исследования было выявлено повышение систолического артериального давления.
По словам соавтора работы стоматолога Луизы Белфилд, важность микробиома ротовой полости является недооцененной. Данное исследование стало еще одним доказательством того, что большинство бактерий в организме необходимы для поддержания здоровья.
– Ополаскиватели для полости рта изменяют баланс бактерий, а потому должны подбираться индивидуально, их нужно фактически прописывать в виде рецепта. Наша работа стала первым шагом в достижении этой цели, – заявила Белфилд.
Ученые отметили, что продолжат исследования различных антисептических препаратов для получения дополнительных сведений об их влиянии на бактериальный состав организма.
Разница между рН и буфером (Наука и природа)
ключевое отличие между рН и буфером является то, что рН представляет собой логарифмическую шкалу, тогда как буфер представляет собой водный раствор.
Мы можем использовать pH жидкости, чтобы определить, является ли она кислотой или основанием. Это также полезно при определении буферной емкости буфера. Буферный раствор содержит смесь слабой кислоты и сопряженного с ней основания или наоборот. Следовательно, он имеет тенденцию сопротивляться изменениям рН раствора..
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое рН
3. Что такое буфер
4. Сравнение бок о бок – рН против буфера в табличной форме
5. Резюме
Что такое рН?
pH – это логарифмическая шкала, которую мы используем для определения кислотности или основности водного раствора. Это отрицательный логарифм по основанию 10 концентрации ионов водорода, измеренный в единицах моль / л. Если выразить это более точно, мы должны использовать активность ионов водорода вместо концентрации. Шкала рН имеет номера от 0 до 14. Растворы, имеющие рН менее 7, являются кислотными, и если рН выше 7, это основной раствор. РН 7 обозначает нейтральный раствор, то есть чистую воду.
Рисунок 01: pH различных компонентов
Уравнение для определения pH выглядит следующим образом:
pH = log10(аЧАС+)
Здесь «а» – активность ионов водорода (Н+). Значение рН зависит от температуры раствора, так как температура может изменить активность химических веществ. Поэтому, давая pH водного раствора, мы должны указать температуру, при которой pH измеряется точно. Мы используем шкалу pH для определения качества воды, почвы и т. Д..
Что такое буфер?
Буфер представляет собой водный раствор, который имеет тенденцию сопротивляться изменению рН. Этот раствор содержит смесь слабой кислоты и ее сопряженного основания или наоборот. PH этих растворов слегка изменяется при добавлении сильной кислоты или сильного основания.
Слабая кислота (или основание) и ее сопряженное основание (или сопряженная кислота) находятся в равновесии друг с другом. Затем, если мы добавим немного сильной кислоты в эту систему, равновесие сместится в сторону кислоты, и она образует больше кислоты, используя ионы водорода, высвобождаемые из добавленной сильной кислоты. Поэтому, хотя мы ожидаем увеличения ионов водорода при добавлении сильной кислоты, оно не увеличивается так сильно. Точно так же, если мы добавим сильное основание, концентрация ионов водорода уменьшится меньше, чем ожидаемое количество добавленной щелочи. Мы можем измерить эту устойчивость к изменениям pH как буферную емкость. Емкость буфера измеряет устойчивость буфера к изменению рН при добавлении ОН– ионы (основание). Мы можем дать это в уравнении следующим образом:
β = дп/ Д (рН)
где β – буферная емкость, dn – бесконечно малое количество добавленного основания, а d (pH) – результирующее бесконечно малое изменение pH..
При рассмотрении применения буферов, эти растворы необходимы для поддержания правильного рН для ферментативной активности в организмах. Кроме того, они используются в промышленности в процессах ферментации, в установлении правильных условий для красителей, в химическом анализе, калибровке рН-метров и т. Д..
Какая разница между рН и буфером?
pH – это логарифмическая шкала, которую мы используем для определения кислотности или основности водного раствора, тогда как буфер представляет собой водный раствор, который имеет тенденцию сопротивляться изменению pH. Это ключевое различие между pH и буфером. Кроме того, pH является очень важной шкалой в химии. Мы можем измерить pH раствора с помощью pH-метра или экспериментальными методами. Кроме того, мы используем шкалу рН для определения качества воды, почвы и т. Д. С другой стороны, использование буферных растворов позволяет поддерживать правильный рН для ферментативной активности, в процессах ферментации в промышленности, в установлении правильных условия для красителей, в химическом анализе, калибровке рН-метров и т. д. Мы измеряем буферную емкость буфера с помощью химического анализа.
Резюме – рН против буфера
pH – это фундаментальная шкала, которую мы используем в химии для измерения кислотности или основности раствора. Буферы – это химические растворы, которые могут противостоять изменениям pH. Следовательно, разница между pH и буфером заключается в том, что pH представляет собой логарифмическую шкалу, тогда как буфер представляет собой водный раствор..
Ссылка:
1. «PH.» Википедия, Фонд Викимедиа, 3 августа 2018 г. Доступно здесь
2. «Буферное решение». Википедия, Фонд Викимедиа, 27 июля 2018 года. Доступно здесь
Изображение предоставлено:
1. «PH Scale» Эдварда Стивенса – собственная работа (CC BY 3.0) через Commons Wikimedia
Measurement and Analysis of Extracellular Acid Production to Determine Glycolytic Rate
Общая цель этого метода является точно измерить скорость гликолиза клеток с использованием анализа внеклеточной потока. Количественное измерение скорости гликолиза, используя внеклеточный подкисления является искомым конечная точка многих экспериментах. Тем не менее, общая скорость внеклеточного подкисления является суммой двух составляющих: дыхательная подкисление, в виде СО 2 (который увлажняет Н 2 СО 3, то распадается на НСО 3– + Н +), и гликолитического подкисления, в виде лактата – + Н +.
Вклады CO 2 в общей внеклеточной подкисления до недавнего было считать незначительным в измерительной платформы, используемой здесь, в XF24 анализатора 7. Тем не менее, очевидно, в нескольких других систем, которые CO 2 может быть одной из основных причин внеклеточной подкисления 4-5. Несколько статей признать этот конвклад, но не пытайтесь прямой количественный СО 2 -derived кислоты 3,8,9. Недавно мы показали, что количественно СО 2 производство является значительным источником внеклеточной подкисления в этой системе 6. Кроме того, хотя существует множество метаболических путей, которые генерируют СО 2 из катаболизма глюкозы, тем осуществляется матричных дегидрогеназ в цикле лимонной кислоты подавляющие Авторы и все другие источники генерации количество CO 2, которые в пределах экспериментальной ошибки 6.
Без коррекции СО 2 производства внеклеточного подкисления, следовательно, является неоднозначным показателем гликолитического скорости и не могут быть использованы в количественном отношении. Нашей предыдущей публикации подчеркивается несколько случаев, когда дыхательная СО 2 содержит основную часть общего сигнала подкисления, даже в клетках, как правило, как полагают, в основном, используют гликолиз 6. Кроме того,дыхательная СО 2 вклад в общую подкисления широко варьируется в ходе общих метаболических экспериментах профилирования, демонстрируя, что правильно сравнение гликолитического скоростью в разные части эксперимента требует коррекции для CO 2.
Для измерения скорости гликолиза клеток с использованием скорости внеклеточной подкисления, необходимо преобразовать изменение рН на изменения в общем H +, генерируемых и вычесть внеклеточный подкисление вызванное CO 2 выделяется при работе в цикле лимонной кислоты. Здесь мы опишем простой метод для измерения внеклеточной дебит протонов (с внеклеточной изменения рН и калиброванного буферизации власти анализа среды) и СО 2 производства (от внеклеточного изменений в O 2 концентрации), и продемонстрировать, как рассчитать гликолитический скорость На основе этих измерений.
Эта сила метод ENS утилиту внеклеточного подкисления измерения, используя его правильно рассчитать скорость гликолиза, как определено лактата. Без коррекции дыхательных CO 2 (или прямого измерения лактата), невозможно определить, если и в какой степени общий уровень кислотности отражает гликолитический скорость, не оправдав интерпретацию экспериментов, использующих общую внеклеточный подкисления в качестве прямого измерения лактата.
РАСЧЕТ
СО 2 и лактата, в пределах экспериментальной ошибки, только два вклад в производство внеклеточной кислоты, основанные на экспериментах с клетками миобластов 6. Таким образом, скорость общего внеклеточного подкисления (PPR, дебита протон) может быть определена как:
PPR PPR малыш = соответственно + PPR GlycУравнение 1
. _content “>, где малыш = общее; соответственно = дыхания; Glyc = гликолитическая гликолитических PPR такова:PPR PPR Glyc = малыш – PPR соответственноУравнение 2
Вот,
PPR малыш = РВЦА малыш / ВР Уравнение 3
где РВЦА = внеклеточного скорости подкисление (миль / ч / мин), и ВР = буферизации питания (миль / ч / пмоль Н + в 7 мкл), а
ППР = соответственно (10 рН-PK 1 / (1 + 10 рН-PK 1)) (макс Н + / О 2) (OCR TOT – OCR об / MYX)Уравнение 4
где К 1 = комбинированный константа равновесия СО 2 гидратации и диссоциации в НСО 3 – + Н +; макс Н + / O 2 = йе СО 2 -derived подкисление для конкретного метаболической трансформации, таких как полное окисление глюкозы 6; OCR = скорость потребления кислорода (O 2 пмоль / мин), и OCR об / MYX = без митохондриальной OCR.
Уравнение 4 изолирует митохондриальной OCR путем вычитания любого не-митохондриальной OCR (определяется как OCR, которая устойчива к митохондриальной дыхательной ядов ротенона и myxothiazol) и счетов для максимального H +, образованное на O 2 потребляется для каждого субстрата (макс Н + / O 2 ) (см 6), а также доля CO 2 порождая H + на экспериментальной температуры и рН (10 рН-PK 1 / (1 + 10 рН-PK 1). Для полного окисления глюкозы, митохондриальная кислорода Потребление Оценить (OCR) в точности равна скорости CO 2, производства. В ограниченном объеме анализа измерения внеклеточной потока, CO 2, продуктыд дыханием остается в ловушке в среду для анализа. Большая часть захваченных СО 2 увлажненной, чтобы H 2 CO 3, который затем распадается на НСО 3 – + Н +. Небольшая часть остается растворенным, но не гидратированного, а другой небольшая часть является гидратированный, но не диссоциируют, как продиктовано термодинамически комбинированным константа равновесия СО 2 гидратации и диссоциации, чтобы HCO 3– + Н + при температуре эксперимента (37 ° C) и рН (~ 7,4).
Таким образом, полное уравнение для расчета PPR г путем вычитания PPR PPR соотв от TOT является:
PPR Glyc = РВЦА малыш / ВР – (10 рН-PK 1 / (1 + 10 рН-PK 1)) (макс Н + / O 2) (OCR малыш – OCR об / MYX) Уравнение 5
яп Таким образом, темпы дыхания и гликолиза, а также связанных с ними темпы производства АТФ, может быть количественно определена из простых измерений (потребления кислорода, внеклеточный подкисления, буферная емкость) и импорта или расчета других необходимых значений (Н + / вывода 2 , п / о, а константа равновесия K 1) 6. Эксперимент, описанный здесь расширяется на стандартных методов для использования внеклеточной поток анализатор, таких как конек XF24 10,11; для других форматов измерений внеклеточного поток (например, XF е 96, или XFP), все объемы ниже должны быть расширены соответствующим образом.
Буферный мощность в среду для анализа может быть измерена путем построения калибровочной кривой либо непосредственно во внеклеточном платформы потока или отдельно с помощью калиброванного рН зонда. Здесь три варианта для измерения буферизации внеклеточным потока среды для анализа даны, в том числе с использованием всех injectiна портах внеклеточного анализатора потока с скважин образцов клеточных бесплатно, либо с использованием только последней инъекции порт в ячейке, содержащей скважин (раздел 1), или с помощью внешнего измерения рН (раздел 2). См.прикрепленную таблицу для полных расчетов, например, данные.
Для измерения буферизации питание с помощью рН-обнаружения возможности внеклеточного инструмента потока, это самый безопасный в использовании бесклеточных скважин, чтобы минимизировать изменение сигнала. Тем не менее, в пределах погрешности, статистической разницы не существует между бесклеточной и клеточно-содержащий скважин при выполнении этого измерения (данные не показаны). Примечание: Изменение описано на стадии 1.7 осуществляет преимущество составляет любых потенциальных изменений в буферизации, предоставляемых добавленных соединений или в присутствии клеток, с недостатком шумной сигнала. Однако, как указано выше, никаких существенных различий не было обнаружено в расчетной мощности между буферным конструкции бесклеточной показанном в таблице 1, идизайн после эксперимента в таблице 2 в экспериментальных условиях, описанных здесь.
Кроме того, на малых диапазонах ΔpH (<0,4 единиц; экспериментально лучше ограниченные до 0,2 единиц), то линейный наклон получается путем построения Д миль / ч / мкмоль H + адекватно приблизительно логарифмическая зависимость между ΔpH и [H +]. Наклон стандартной кривой, следовательно, представляет собой буферную силу в среду для анализа тестируемого рН / нмоль H + в 7 мкл или миль / ч / пмоль Н + 7 мкл. Мы рекомендуем увеличение средней мощности буферизации или уменьшением плотности клеток в образцах, которые превышают единичное изменение рН 0,2 в течение времени измерения. Время измерения также может быть уменьшена, но это может привести к сокращению установившейся скорости подкисления и ввести ошибку в расчете скорости.
Щелочность и буферность воды
Справочные главы: 6, 8
Цели
После проведения этого эксперимента студент сможет:
• Определите щелочность и буферную способность нескольких типов проб воды: поверхностной воды, подземной воды (минеральной воды) и морской воды.
• Приготовьте различные растворы или смеси кислот и их сопряженных оснований (т.е. буферы) и измерьте их буферную способность титрованием кислотами и основаниями.
• Рассчитайте концентрации кислоты и ее конъюгированного основания, чтобы создать буфер для желаемой буферной емкости при определенном pH.
• Подготовьте буферную систему.
Введение
Этот эксперимент позволит определить щелочность и буферную способность образцов воды из различных природных источников. Буферная емкость – это способность нейтрализовать pH и сопротивление его изменению из-за небольших поступлений или сбросов кислот или щелочей.Когда система плохо забуферена, добавление даже небольших количеств кислоты или основания заметно изменит ее pH, но когда система хорошо забуферирована, то же самое добавление почти не изменяет ее pH (т. Е. Становится относительно нечувствительным к добавлению. небольшого количества кислот или оснований). Буферная емкость системы определяется как моль / л сильной кислоты (или сильного основания), необходимой для изменения одной единицы pH раствора. Типичный буфер образован комбинацией слабой кислоты
(или основание) с соответствующей солью.H + q) + A ~ вод.) (La)
Константа равновесия (кислотности) равна: [H +] [A]
, из которого мы можем вывести уравнение p Ka (= – log Ka) относительно pH:
Это известно как уравнение Хендерсона-Хассельбаха, и оно построено в предположении, что [H +] или [OH-] «[HA] и [A ~], где HA = слабая кислота, а A ~ = соответствующий анион, образованный из соль. В хорошо забуференной системе наибольшая устойчивость к изменениям pH будет иметь место, когда соотношение концентраций кислоты и ее соли приблизительно равно, и, следовательно, yKa будет равно ее pH.Из приведенного выше уравнения ясно, что это происходит при [A ~] / [HA] = 1.
Зная pKa буферной кислоты, можно оценить pH, при котором будет сосредоточена ее наибольшая буферная способность. На pH буферного раствора влияют два фактора: соотношение концентраций [A -] / [HA] (т.е. обратное отношение кислоты к основанию конъюгата) и сила исходной кислоты или основания. Чем сильнее исходная кислота или основание в буферном растворе, тем более экстремальным будет значение pH буфера.
Буферная способность зависит от концентрации буфера, а также от типа и концентрации кислоты или основания, добавляемого в буферный раствор. При выборе правильного рабочего буфера для заданного pH обычно учитывают, что его pKa
Значениедолжно быть по крайней мере на одну единицу pH выше или ниже рабочего pH.
Буферная способность природных вод в основном обусловлена карбонатной системой и ее равновесиями. Поэтому важно знать щелочность системы, потому что это обеспечит способность нейтрализовать кислоту.Выражение для щелочности (т.е. только для растворенных веществ) или кислотонейтрализующей способности (ANC) (т.е. для всего образца) обычно основано на карбонатной системе:
, и это свойство выражается в мг / л (или в экв / л, в случае ANC) эквивалентного карбоната кальция.
ANC природных водных систем зависит от состава водосбора. Если в окружающей почве присутствуют минералы с плохой растворимостью, ANC будет низким, тогда как при наличии известковых минералов ANC будет высоким.Некоторые растворенные органические вещества, полученные из разлагающихся растительных материалов, также могут влиять на способность воды к АНК.
В этом эксперименте ученик будет использовать образцы, как те, которые рассматриваются в эксперименте 1, и определять их щелочность и буферную способность. Учащийся также подготовит серию растворов, в которых концентрация известной конъюгированной соли будет варьироваться, измерит, как буферная емкость изменяется в зависимости от пропорций соли, и рассчитает диапазон или пределы буферизации.В этом случае будет определена доля соли, которая дает наивысшую буферную емкость или диапазон (и соответствующий ей pH). Наконец, ученик рассчитает состав буферного раствора, необходимый для достижения заданного pH; подготовить его на основе теоретических концепций и уравнений и измерить его pH и буферную способность.
Методика эксперимента
Расчетное время, необходимое для завершения эксперимента: это зависит от количества проанализированных образцов (примерно 5-20 минут на образец на анализ).
Этот эксперимент можно проводить в один или два сеанса.
Первым делом нужно взять пробы воды. Студент должен получить образцы из первоисточников, аналогичные тому, что было сделано для эксперимента
.1. Подходящие пробы включают речную или озерную воду, грунтовые воды (если возможно, из колодца, а если нет, образец бутилированной минеральной воды – предпочтительно из природного источника), морскую воду (если она недоступна, ее можно приготовить синтетическим путем или получить из коммерческого источника).Пробы должны быть собраны в чистые полиэтиленовые бутыли и проанализированы сразу после отбора проб; в противном случае значения могут существенно отличаться.
Материалы | Реактивы | |
1 pH-метр с тонкой пробиркой | Минеральные или подземные воды | |
Комбинированный электрод pH | речная или озерная вода | |
бутылки полиэтиленовые | морская вода | |
4 стакана по 50 мл | Д.I. вода | |
1 мерная пипетка 1 мл | 0,25 М, 0,1 М NaOH | |
2 Микробюретка 2 мл | Индикатор фенолфталеина | |
1 трехпальцевый зажим | индикатор метилового оранжевого | |
2 Берал пипец | индикатор бромкрезолового зеленого | |
5 мензурок 25 мл | 0.25 M, 0,1 M, 0,01 M HCl | |
2 мерные пипетки 10 мл | 0,01 М Na2S203 | |
1 Мерная пипетка на 2 мл | 0,1 | М Na2C03 |
3 Колба Эрленмейера 10 мл | 0,1 | M NaHC03 |
2 пропипетные лампы или адаптированные | 0.1 | М Х3П04 |
шприца | 0,1 | М K2HP04 |
1 универсальная подставка | 0,1 | млн h4P04 |
1 зажим бюретки | ||
2 мерные пипетки 5 мл | ||
1 градуированная пипетка 2 мл (1/100) | ||
1 перемешивающая пластина | ||
1 микромагнитная мешалка | ||
5 мерных колб 25 мл | ||
1 мерная колба на 50 мл | ||
2 бюретки 25 мл | ||
В первой части эксперимента (часть A) измеряется pH и щелочность образцов воды и сравниваются их значения, а также значения водопроводной и дистиллированной или деионизированной воды.Щелочность будет измеряться титрованием разбавленной соляной кислотой до трех конкретных значений pH: 8,3, 7 (т.е. нейтральность) и 4,5. Это позволит рассчитать различные вклады веществ, ответственных за щелочность. Кислотно-основной индикатор фенолфталеин используется для обозначения конечной точки 8,3 и для определения Р-щелочности. Результаты можно лучше всего интерпретировать в свете обсуждения Раздела 6.3.1.1 и Примера 6.5.
Чтобы определить количество кислоты, необходимое для достижения 4.5 можно использовать индикаторы метилового оранжевого или бромкрезолового зеленого. Это титрование указывает на присутствие остальной части присутствующих карбонат-ионов (когда он достигает pH около 6,5) и всех присутствующих бикарбонат-ионов до pH 4,5. Общее количество кислоты указывает на общую щелочность. Для более точного титрования необходимо следить за pH с помощью pH-метра. Учащийся сравнивает количество каждого добавленного титранта и pH каждого образца, помимо определения щелочности и графического определения буферной способности каждого образца.Студент также определит слабые или сильные буферы.
Во второй части эксперимента (Часть B) ученик будет готовить растворы с различными пропорциями карбонатных и фосфатных солей и титровать их, чтобы оценить их пределы буферизации и пропорцию, которая обеспечит наилучшую буферную емкость. Студент будет наблюдать эффект изменения пропорций кислоты к основанию конъюгата, а также изменения концентрации присутствующих буферных компонентов.Также будут отмечены различия между используемыми сопряженными системами.
В Части C студент будет использовать уравнение Хендерсона-Хассельбаха, чтобы определить соотношение конъюгата основание / слабая кислота, чтобы обеспечить желаемый pH и подготовить его экспериментально. Начальный pH и буферная емкость затем определяются титрованием, и они отслеживаются по изменениям pH, возникающим в результате добавления определенных количеств стандартизированной кислоты или основания.
Меры безопасности
Титранты не должны попадать на кожу или в глаза, так как они могут вызывать коррозию.Студент должен учитывать все меры безопасности, которые обычно принимаются при работе с такими реагентами. В случае разлива раствора кислоты или контакта с кожей протрите чистой тканью и тщательно и обильно промойте водой (сбрызните стол или поверхность бикарбонатом натрия). Все остатки, образовавшиеся в этом эксперименте, можно сливать в канализацию после того, как они будут нейтрализованы.
Экспериментальная последовательность Расчетное необходимое время: 5 мин на образец Часть A. Измерение щелочности или ANC Образцы и процедура:
1.Соберите образцы (или приготовьте их синтетическим путем): (1) речной или озерной воды, (2) океанской воды, (3) минеральной воды (или, если есть, используйте грунтовые воды), (4) водопроводной воды и (5) D.I. воды. Используйте откалиброванный pH-метр на протяжении всего эксперимента и подождите, пока не будут получены стабильные показания.
2. Измерьте pH и температуру каждого образца. Если pH выше 8,3, определите P-щелочность. Если это не так, только М-щелочность (то есть щелочность метилового оранжевого или бромкрезолового зеленого при pH = 4.3) можно измерить.
3. Если pH <4,3, измерьте кислотность пробы.
4. Чтобы предотвратить маскировку конечной точки при использовании цветных индикаторов, убедитесь, что образец бесцветный и не мутный. Для этого отфильтруйте образец перед титрованием и, если цвет был проблемой, добавьте небольшое количество активированного угля (перед фильтрацией). Фильтрацию можно проводить с помощью шприца, снабженного фильтродержателем и тонкопористым фильтром. Чтобы исключить свободный хлор, который может помешать титрованию, добавьте одну-две капли 0.01 М тиосульфат натрия.
5. Поместите микробюретку на подставку, промойте ее небольшим количеством 0,01 М кислотного титранта и заполните до желаемой отметки.
6. С помощью мерной пипетки возьмите 10 мл пробы воды и поместите ее в химический стакан на 25 или 50 мл. Поместите микромагнитную мешалку в стакан и поставьте стакан на перемешивающую пластину. Погрузите колбу pH-электрода в жидкую пробу, не касаясь стержня мешалки. Измерьте pH.
7. Добавьте 2–3 капли индикатора фенолфталеина (например,г., пипеткой Берала). Обратите внимание, появляется ли какой-либо цвет.
8. Если при добавлении индикатора P цвет отсутствует, значит щелочность P равна нулю. В этом случае немедленно добавьте 1-2 капли индикатора метилового оранжевого (или бромкрезолового зеленого) и начните титрование до конечной точки.
9. Если при добавлении индикатора фенолфталеина появляется розовый цвет, титруйте по каплям (с шагом 0,1 или 0,2 мл), осторожно перемешайте и запишите полученный pH и объем добавленного титранта. Обратите внимание на значение pH в момент исчезновения цвета индикатора (оно должно быть близко к 8.3). Затем немедленно добавьте 2–3 капли индикатора метилового оранжевого (или бромкрезолового зеленого) и продолжайте титрование до тех пор, пока не будет достигнута точная конечная точка 4,5 (раствор становится лососевым в случае метилового оранжевого или желтоватым в случае индикатора бромкрезолового зеленого).
10. Повторите тот же метод для каждой пробы воды.
B. Буферная емкость
Расчетное необходимое время: 15 мин на образец
Метод
Б.л. Буферная емкость природных образцов.Измерения, проведенные в части А для определения щелочности нескольких проб воды, также будут служить для определения буферной способности каждой пробы.
B.2 Факторы, влияющие на pH и буферную способность
B.2.1 Приготовьте раствор Na2C03 + NaHCO3, введя мерной пипеткой 10 мл свежеприготовленных 0,1 М растворов каждой соли в мерную колбу на 25 мл. Добавить D.I. вода до отметки. Тщательно перемешайте и перелейте полученный раствор в стакан на 50 мл.
(a) На основе известных значений pKa и уравнения Хендерсона-Хассельбаха рассчитайте pH этого раствора.
(b) Сразу после приготовления раствора измерьте его pH, поместив pH-электрод внутрь раствора и считывая стабилизированное значение. Помните, что если раствору дать отдохнуть в течение длительного времени, в нем растворится атмосферный CO2 и значения pH изменятся.
(c) Промойте бюретку объемом 25 мл 0,25 М HCl и заполните ее тем же раствором кислоты.Начните титрование раствора с помощью зонда pH внутри, осторожно перемешивая магнитной мешалкой. Добавьте немного кислоты. Запишите объем добавленной кислоты и полученный pH; убедитесь, что добавление кислоты приводит к изменению pH в полученном растворе более чем на одну единицу. Предпочтительно в последней части титрования переключаться с бюретки объемом 25 мл на микробюретку, чтобы добавлять небольшие порции (например, 0,1 мл) до самого низкого достижимого постоянного значения pH. Запишите все свои данные.
Б.2.2 Действуйте точно так же, как в пункте B.2.1, но используйте по 5 мл каждого раствора карбоната и бикарбоната
.Кислота | Основание конъюгата | Ка | пКа | |||
h4PO4 | h3POJ | 7,62 x 10 дюймов 3 | 2.- | PO3 “ | 2,2 x 10 дюймов 13 | 12,67 |
(вместо 10 мл) и следуйте той же методике, которая установлена в B.2.1 (a) – (c).
B.2.3 Действуйте точно так же, как в пункте B.2.1, но используйте 10 мл раствора Na2C03 и 1 мл раствора NaHCO3.
B.2.4 Действуйте точно так же, как в пункте B.2.1, но используйте 10 мл раствора NaHC03 и 1 мл раствора Na2C03.
B.2.5 Действуйте точно так же, как и во всех предыдущих шагах, но используйте 5 мл раствора Kh3PO4 и 5 мл раствора K2HPO4.
C. Расчет, приготовление и оценка буферного раствора с заданным pH
Расчетное необходимое время: 20 мин на образец
Метод
C.l На основе значений Ka для фосфорной системы (см. Таблицу C.l) и уравнения Хендерсона-Хассельбаха студенческие группы подготовят 50 мл фосфатного буфера с требуемым pH. (Пропорции, использованные в эксперименте Б.2.5 здесь не разрешены). Например, группы могут приготовить буферы со значениями pH 4, 5, 6, 7, 8 или выше.
Каждая группа затем возьмет соответствующий буфер и измеряет буферную емкость кислоты и емкость основной буферизации, используя следующий метод. Используйте откалиброванный pH-метр на протяжении всего эксперимента и подождите, пока не будут получены стабильные показания.
C.2.a Сразу после приготовления раствора фосфатного буфера поместите 25 мл в стакан на 50 мл и измерьте его pH.
C.2.c Повторите процесс с другой 25 мл аликвотой буферного раствора, но на этот раз титруйте 0,25 М NaOH. Запишите все объемы титрования.
Имя_Раздел_Дата_
Instructor_Partner_
Прочтите здесь: Отчет о предварительных лабораторных испытаниях Sheetexperiment
Была ли эта статья полезной?
Как рассчитать буферную емкость
Обычно используемые буферы состоят либо из слабой кислоты и ее конъюгированного основания, либо из слабого основания и конъюгированной кислоты.
Буферный раствор – Примеры
- HCO 3 – / CO 3 2- буфер
- H 2 PO 4 – / HPO 4 2- буфер
- CH 3 COOH / CH 3 COO – Na + буфер
Когда мы хотим приготовить буферный раствор, берем,
- Кислота, имеющая значение pKa, наиболее близкое к требуемому pH, и ее конъюгированная основная соль или,
- Основание, которое имеет значение 14-pKb, наиболее близкое к требуемому pH, и его соль сопряженной кислоты.
Буферное соотношение двух компонентов находится по знаменитому уравнению Хендерсона-Хасселя Баха
pH = pKa + log B / A (B = основание, A = кислота)
Объем буфераЕмкость буфера показывает, насколько прочен буфер с точки зрения устойчивости к любому добавлению основания или кислоты. Это зависит от двух факторов: буферного соотношения и фактических концентраций двух компонентов.Буфер считается сильным, когда оба компонента находятся в равных концентрациях. Это происходит, только если pH = pKa или 14-PKb. Кроме того, мы знаем, что буферный коэффициент можно получить несколькими способами.
Например, если B / A = 2, то его можно получить с помощью,
B = 2 формы -3 и A = 1 форма -3
B = 0,2 формы -3 и A = 0,1 формы -3
B = 0,02 пресс-формы -3 и A = 0,01 пресс-формы -3 и т. Д.
Однако было показано, что чем выше концентрация, тем выше буферная емкость.
Объем буфера определяется индексом буфера β.
β = ∆B / ∆pH
∆B = количество добавленной сильной кислоты или сильного основания (в молярной форме -3 ) и ∆pH = разница pH, вызванная добавлением сильного основания или сильной кислоты.
Как рассчитать буферную емкостьШАГ 1: Возьмите 1 дм 3 интересующего буфера (1 литр)
ШАГ 2: Измерьте начальный pH с помощью точно откалиброванного pH-метра, pH x .
ШАГ 3: Добавьте известное количество сильной кислоты / сильного основания и хорошо перемешайте раствор, чтобы он уравновесился.
ШАГ 4: Измерьте конечный pH смеси с помощью точно откалиброванного pH-метра, pH –.
ШАГ 5: РАСЧЕТ
Для иллюстрации я использую уксусный буфер, добавленное количество NaOH = 0,02 моль, pH x = 4,75 pH y = 5,20
Подставляя в уравнение,
β = ∆B / ∆pH = 0,02 моль / (5,20-4,75)
= 0.044моль
ПРИМЕЧАНИЕ: Буферная емкость всегда рассчитывается на 1 дм 3 буфера. Если вы используете другой буферный объем, всегда рассчитывайте соответственно.
Скажем, указанная выше разница pH была получена для 500,0 см 3 буфера, тогда β = (0,044 моль / 2) = 0,022 моль
Поскольку объем равен 1/2 от 1 дм 3 , полученное значение умножается на 1/2.
Влияние кислот на лесные деревья, измеренное титрованием in vitro, наследование буферной емкости у Picea abies
Влияние кислот на лесные деревья, измеренное титрованием in vitro, наследование буферной емкости у Picea abies | Treesearch Перейти к основному содержанию The.gov означает, что это официально.
Веб-сайты федерального правительства часто заканчиваются на .gov или .mil. Прежде чем делиться конфиденциальной информацией, убедитесь, что вы находитесь на сайте федерального правительства.
Сайт безопасен.
https: // гарантирует, что вы подключаетесь к официальному веб-сайту и что любая предоставляемая вами информация шифруется и безопасно передается.
Тип публикации:
Общий технический отчет (GTR)
Первичная станция (и):
Северная научная станция
Исторический (ые) вокзал (а):
Северо-восточная исследовательская станция
Источник:
В: Дочингер, Л.S .; Селига Т.А., ред. Материалы первого международного симпозиума по кислотным осадкам и лесной экосистеме; Gen. Tech. Реп. NE-23. Аппер Дарби, Пенсильвания: Министерство сельского хозяйства США, Лесная служба, Северо-восточная лесная экспериментальная станция. 971-976
Описание
Воздействие кислых осадков на растительность является результатом взаимодействия кислоты и растений.Метаболизм растений зависит от оптимальных значений pH, которые поддерживаются регулированием. Существуют различия в эффективности регулирования при таких экзогенных воздействиях, как кислые осадки. Эти различия могут быть связаны с устойчивостью растений к кислым осадкам или к определенным патогенным грибам. Такие различия измеряли как буферную способность гомогенизированных листьев во время титрования кислотой. Существуют значительные различия в буферной емкости между клонами Pinus spp.и Picea abies. Значительная разница в буферной способности также была обнаружена среди семейств P. abies. Расчеты генетических параметров показывают, что фенотипическая изменчивость буферной способности определяется в основном генетическими факторами.
Цитата
Scholz, F .; Reck, S. 1976. Действие кислот на лесные деревья, измеренное титрованием in vitro, наследование буферной емкости у Picea abies.В: Dochinger, L. S .; Селига Т.А., ред. Материалы первого международного симпозиума по кислотным осадкам и лесной экосистеме; Gen. Tech. Реп. NE-23. Аппер Дарби, Пенсильвания: Министерство сельского хозяйства США, Лесная служба, Северо-восточная лесная экспериментальная станция. 971-976
Примечания к публикации
- Мы рекомендуем вам также распечатать эту страницу и прикрепить ее к распечатке статьи, чтобы сохранить полную информацию о цитировании.
- Эта статья была написана и подготовлена служащими правительства США в официальное время и поэтому находится в открытом доступе.
https://www.fs.usda.gov/treesearch/pubs/11510
Применение буферов, уравнение буфера и емкость буфера: Фармацевтические рекомендации
В результате присутствия небольших количеств органических кислот или щелочей в кристаллических соединениях, буферы предотвратить изменение pH раствора кислотой или щелочью.Необходимость буферов – Бывают случаи, когда необходимо приготовление и хранение раствора с определенным pH. Этот процесс даже сложнее, чем приготовление самого раствора. CO2 в растворе абсорбируется из воздуха и становится кислым. Содержащие щелочные примеси в стеклянных бутылках могут изменять pH раствора, поэтому фармацевтические растворы забуферены, так что pH будет оставаться относительно постоянным при добавлении даже незначительных количеств кислоты или основания.
Применение буферов
Уровни pH обычно поддерживаются с помощью биологических буферов в фармацевтической промышленности.- Стабилизируйте компоненты препарата: не позволяйте желудочно-кишечной среде разрушать или изменять значение pH основных компонентов, таких как аспирин.
- Очистите определенные компоненты, такие как инсулин, путем их разделения и очистки.
- Убедитесь, что лекарство растворено: некоторые ингредиенты растворяются только при определенных уровнях pH.
- Убедитесь, что ингредиенты биологически активны: некоторые ингредиенты, такие как пепсин, не могут поддерживать свою активность ниже определенного уровня pH.
- Способность лекарства вводиться в организм человека: инъекции точно соответствуют значениям pH крови; глазные капли точно соответствуют условиям вокруг глаза.
- Он подавляет выработку кислоты в желудке, действуя в качестве буфера, снижая содержание кислоты в желудке.
- В биологических системах – Две буферные системы поддерживают pH крови на уровне 7.4. Во-первых, это плазма. Первичный буфер находится в плазме. В плазме присутствует два типа кислот / щелочей: угольная кислота и карбонат натрия. В эритроцитах вторичными буферами являются оксигемоглобин, гемоглобин и калиевые соли кислой и щелочной фосфорной кислоты.
- В фармацевтических системах – аптеки используют буферы для обеспечения максимальной стабильности продуктов за счет регулирования их уровней pH. Если вы собираетесь использовать парентеральные препараты (например, инъекции), вам следует быть осторожными с pH, поскольку большие отклонения потенциально опасны.Продукты для парентерального введения должны иметь pH 7,4, то есть pH крови. В составе парентеральных препаратов (инъекций) в качестве буферов часто используются ацетат, фосфат, цитрат и глутамат.
Уравнение буфера
Уравнение Хендерсона-Хассельбаха также известно как уравнение буфера.Для кислотных буферов – Значение pH можно рассчитать путем сравнения константы диссоциации K слабой кислоты с концентрациями кислоты и соли. Вот как выглядят проявления диссоциации слабых кислот.
HA ↔ H + + A-
Ka = [H +] [A-] / [HA]
Или [H +] = Ka [HA] / [A-] ———– – (1)
Слабые кислоты диссоциируют лишь незначительно, и их диссоциация дополнительно подавляется добавлением A-иона (общий ионный эффект), что приводит к равновесной концентрации неионизированной кислоты, которая почти такая же, как ее исходная. концентрация после объединения в профсоюзы. Мы предполагаем, что равновесная концентрация A- равна концентрации соли, добавленной в начале, из-за ее полной диссоциации.Концентрация A- представлена концентрацией соли в уравнении (1) выше.
[H +] = Ка. [Кислота] / [Соль] ——— (2)
Если вы возьмете бревна с обеих сторон, мы получим:
log [H +] = logKa + log [Acid] / [Salt]
, когда обе стороны умножаются на –ve,
-log [H +] = -logKa – log [Кислота] / [Соль]
As -log [H +] = pH & -logKa = pka pH = pka – log [Кислота] / [Соль] ИЛИ pH = pka + log [Соль] / [Кислота] ———- (3)
Уравнение (3) известно как уравнение Хендерсона-Хассельбаха.Зная концентрации кислоты и соли, он помогает рассчитать значение pH буферного раствора.
Для основных буферов – На основе того же принципа, что и для кислых буферов, мы можем вычислить уравнение буфера для основных буферов. Предположим, что основной буфер состоит из смеси слабых органических кислот (BOH) и их солей (BA). Мы можем записать константу диссоциации для основания следующим образом:
BOH ↔ B + + OH- Kb = [B +] [OH-] / [BOH] OR [OH-] = Kb [BOH] / [B +] — ———- (1)
Другими словами, баланс между равновесными концентрациями неионизированного основания и его начальными концентрациями близок.Это связано с тем, что слабое основание лишь слегка диссоциирует солью BA, обеспечивая ион B + (общий ионный эффект). Поскольку к моменту достижения равновесия соль полностью диссоциировала, предполагается, что B + имеет ту же равновесную концентрацию, что и первоначально добавленная соль. Соответственно, в уравнении (1) концентрация соли используется как мера концентрации B +.
[OH-] = Кб. [Base] / [Salt] ——— (2)
Сложив два журнала вместе, мы получим:
log [OH-] = logKb + log [Base] / [Salt]
Добавление знака –ve к обеим сторонам,
-log [OH-] = -logKb – log [Base] / [Salt]
As -log [OH-] = pOH & -logKb = pkb pOH = pkb – log [Основание] / [Соль] Или pOH = pkb + log [Соль] / [Основание] —– (3)
Объем буфера
Добавление кислоты или основания в буферный раствор изменит его буферную емкость, которая измеряет его устойчивость к изменениям pH.Помимо емкости буфера, другие термины для емкости буфера – это значение буфера, эффективность буфера и коэффициент буфера. Буферная емкость, для которой обозначается символ «β», также может быть определена следующим образом:Отношение между небольшим увеличением кислотности или щелочности (добавленное количество) и небольшим изменением pH (ΔpH), возникающим в результате его добавления.
β = ΔA или ΔB / ΔpH
Вы можете изменить pH буфера, смешивая с ним градации сильной кислоты или основания (в граммах-эквивалентах или литрах).К одному литру раствора необходимо добавить один грамм сильной кислоты или основания, чтобы отрегулировать его pH на одну единицу. Следовательно, если уровень pH раствора изменяется меньше при добавлении кислоты или основания, буферная емкость выше, и наоборот.
Стандартизированный метод определения буферной способности листвы растений на JSTOR
АбстрактныйМетод определения буферной емкости (BC) экстрактов листвы был стандартизирован и оценен.Выявлены источники вариаций (биологические, полевые и лабораторные). Эти различия отражались в межвидовых различиях, сезонных колебаниях, возрасте листвы и продолжительности, а также в условиях хранения экстрактов. Были рекомендованы процедуры для устранения или сведения к минимуму источников отклонений (кроме присущих специфическим) путем стандартизации отбора проб в полевых условиях, лабораторной обработки и методов, а также расчетов буферной емкости. Такие растения, как лишайники, которые, как известно, чувствительны к загрязнителям воздуха, имели очень низкий уровень B.C. тогда как виды со средней чувствительностью, такие как пихта бальзамическая, имели более высокую B.C. B.C. будучи унаследованными и значительно различающимися между видами, имеет потенциал для использования в индексировании относительной чувствительности видов к загрязнителям воздуха, особенно в районах, где необходимо сравнивать большое количество видов.
Информация о журналеPlant and Soil публикует оригинальные статьи и обзорные статьи, исследующие взаимодействие биологии растений и почвоведения и предлагающие четкий механистический компонент.Сюда входят как фундаментальные, так и прикладные аспекты минерального питания, взаимоотношений растений и воды, симбиотических и патогенных взаимодействий растений и микробов, анатомии и морфологии корней, биологии почвы, экологии, агрохимии и агрофизики. Статьи, в которых обсуждается важная молекулярная или математическая составляющая, также попадают в рамки журнала.
Информация об издателеSpringer – одна из ведущих международных научных издательских компаний, издающая более 1200 журналов и более 3000 новых книг ежегодно по широкому кругу вопросов, включая биомедицину и науки о жизни, клиническую медицину, физика, инженерия, математика, компьютерные науки и экономика.
pH и щелочность | УМасс Амхерст MWWP
** Для СОП, утвержденного Департаментом охраны окружающей среды штата Массачусетс, получите файл в формате pdf для озер или для рек **
Справочная информация
pH – это мера концентрации ионов водорода в воде по шкале от 1,0 до 14,0. Чем ниже pH воды, тем она более кислая. Чем выше pH воды, тем она более щелочная или щелочная.pH влияет на многие химические и биологические процессы в воде и разные организмы имеют разные диапазоны pH, в которых они процветают. Большинство водных животных предпочитают диапазон pH от 6,5 до 8,0. pH вне этого диапазона снижает разнообразие в потоке, потому что он оказывает стрессовое воздействие на физиологические системы большинства организмов и может снизить воспроизводство. Низкий pH также может позволить токсичным элементам и соединениям, таким как тяжелые металлы, стать мобильными и «доступными» для поглощения водными растениями и животными.Опять же, это может создать условия, токсичные для водных организмов, особенно для таких чувствительных видов, как форель.
Изменения кислотности могут быть вызваны атмосферным выпадением (кислотный дождь или кислотный шок от таяния снега), окружающими породами и сбросами сточных вод. Технически шкала pH измеряет логарифмическую концентрацию ионов водорода (H +) и гидроксида (OH-), которые составляют воду (H + + OH- = h30). Когда оба типа ионов находятся в равной концентрации, pH равен 7,0 или нейтрален.Ниже 7,0 вода кислая (ионов водорода больше, чем ионов гидроксида). Когда pH выше 7,0, вода щелочная или щелочная (гидроксид-ионов больше, чем ионов водорода). Поскольку шкала логарифмическая, снижение pH на 1,0 означает 10-кратное увеличение кислотности. Таким образом, образец воды с pH 5,0 в десять раз более кислый, чем образец с pH 6,0. pH 4,0 в 100 раз кислотнее pH 6,0.
Щелочность – это мера «буферной способности реки» или ее способности нейтрализовать кислоты.Щелочные соединения в воде, такие как бикарбонаты (пищевая сода – один из видов), карбонаты и гидроксиды, удаляют ионы H + и снижают кислотность воды (что означает повышение pH). Обычно они делают это путем объединения с ионами H + для создания новых соединений. Без этой способности нейтрализовать кислоту любая кислота, добавленная в реку, вызовет немедленное изменение pH. Измерение щелочности важно для определения способности реки нейтрализовать кислотное загрязнение (измеряемое по pH) в результате дождя или таяния снега.Это один из лучших показателей чувствительности реки к поступлению кислоты. Щелочность возникает из-за горных пород и почв, солей, определенных видов деятельности растений и некоторых сбросов промышленных сточных вод. Общая щелочность измеряется путем отбора пробы воды и измерения количества кислоты, необходимой для доведения pH пробы до 4,2. При этом pH все щелочные соединения в образце «израсходованы». Результат выражается в миллиграммах на литр (мг / л) карбоната кальция.
В рамках проекта мониторинга кислотных дождей в Массачусетсе воды классифицируются по щелочности следующим образом:
| 0 * мг / л: Подкисленный | 5-10 мг / л: высокочувствительный |
| 0-2 мг / л: Критический | 10-20 мг / л: чувствительный |
| 2-5 мг / л: под угрозой исчезновения | 20 мг / л: не чувствительно |
* и pH менее 5.0.
Метод отбора проб для рек
Полевое оборудование
- Бутылка для образцов из полиэтилена высокой плотности, 500 мл
- Полевой лист данных
- Охладитель и колит или лед
- Сумка на молнии (размер 1 галлон)
Протокол отбора проб
Пробы следует брать из проточной воды. Вода должна быть глубже бутылок с пробами, и на ней не должно быть накипи и мусора.Если вода на вашем обычном месте отбора проб недостаточно глубока, поищите поблизости другое место, которое в равной степени репрезентативно для этого места, но глубже. Если его нет, не собирайте образец и укажите на своем полевом листе, что уровень воды слишком низкий. Обратите внимание, что отбор проб из стримбанка не рекомендуется, так как это может привести к нерепрезентативным пробам.
Осторожно войти в ручей, поднимаясь вверх по течению, избегая взбалтывания донных отложений. Перед взятием пробы дождитесь, пока не вернутся условия, предшествующие возмущению (из-за перехода вброд).Если вы плывете в каноэ, попросите вашего партнера удерживать его.
Если возможно, возьмите пробу в середине потока. Если нет, отойдите от берега как можно дальше от берега. Пройдите вверх по течению и соберите пробу так, чтобы вы не стояли и не плыли перед бутылкой.
Откройте крышку пробоотборника и трижды промойте речной водой: частично наполните бутыль, закройте крышку, встряхните и опорожните вниз по потоку.
Для взятия пробы полностью погрузите бутыль под воду, наполнив до перелива.
Закройте бутылку крышкой, пока она находится под водой, чтобы удалить воздух из емкости для проб.
Вернитесь на берег и поместите образец в холодильник со льдом.
Заполните лист реки
Метод анализа
Измерение pH
Необходимое оборудование:
- pH-метр
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр на 100 мл (опция для измерения pH)
После калибровки глюкометра с помощью буферов промойте электрод (ы) и стеклянную посуду дистиллированной или деионизированной водой.Тщательно отмерьте 100 мл образца и поместите в стакан на 150 мл для определения pH и щелочности. Поместите промытый электрод в исследуемый образец. Мы настоятельно рекомендуем перед анализом дать всем образцам нагреться до комнатной температуры в плотно закрытой бутылке. Если вы проводите другие анализы с пробой воды, имейте в виду, что pH следует анализировать в течение 5 минут после открытия бутылки с пробой. Образец следует очень осторожно перемешивать, желательно магнитной мешалкой. Для стабилизации показаний может потребоваться до 3 минут.После стабилизации, но не более 5 минут, запишите pH пробы с точностью до 0,01 единицы pH
Измерение щелочности
Необходимое оборудование:
- pH-метр
- Электрод многоразового использования
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр 100 мл
- Цифровой титратор
- 0.Картридж с серной кислотой 16N
После установки картриджа с серной кислотой на место в цифровом титраторе Hach обязательно перемещайте поршень вручную до тех пор, пока титрант не выйдет из выпускного наконечника. Сделайте это, как если бы вы использовали шприц для подкожных инъекций, с поднятым наконечником для удаления пузырьков. Убери все пузыри! Затем продвигайте поршень, используя ручку подачи на конце титратора, до тех пор, пока вы не будете уверены, что наконечник подачи заполнен раствором. Убедитесь в отсутствии утечек в месте соединения наконечника с картриджем.Хорошо промойте наконечник дистиллированной водой или образцом; это важно, потому что титрант концентрированный и немного помогает. Сбросьте счетчик на ноль, и вы готовы к титрованию.
После завершения титрования и записи количества использованного титранта промойте наконечник выдачи дистиллированной водой или следующей пробой, сбросьте счетчик (ЭТО ЛЕГКО ЗАБЫТЬ, КОГДА ЗАНЯТ), и вы сразу готовы к следующей пробе.
Титрование проходит лучше, если наконечник подачи находится под поверхностью титруемого раствора.Для одного или двух образцов титратор можно держать в руке, однако его легче закрепить на кольцевой стойке с помощью зажима. Старайтесь, чтобы титратор оставался вертикальным во время всех титрований; размещение титратора горизонтально на столе между титрованием может привести к появлению пузырьков в наконечнике.
Поставляемые картриджи с кислотой содержат 0,16N серную кислоту. Наши воды, как правило, имеют довольно низкую щелочность, поэтому мы используем специальную процедуру определения щелочности по двойной конечной точке, чтобы точно измерить щелочность ниже 20 мг / л.
После считывания и записи pH, как описано выше, титруйте с помощью цифрового титратора и картриджа с серной кислотой до pH 4,5; записать использованный титрант как A. Продолжайте титрование до pH 4,2. Запишите титрант, использованный до этой точки, как B. Если начальное значение pH меньше 4,5, запишите начальное значение pH. Титровать до тех пор, пока pH не станет на 0,3 единицы ниже начальной точки. Введите цифры титранта, используемые как B; A = 0. Запишите значение pH, на котором вы остановились (для проверки точности).Мы будем использовать компьютеры для расчета щелочности, но вы можете сделать свои собственные расчеты, используя приведенные ниже формулы. Примеры помогут прояснить, какие формулы могут несколько запутать.
A = цифры, используемые для pH 4,5
B = цифры, используемые для pH 4,2 или 0,3 единицы pH ниже начального значения (общий титрант, включая A)
Двойная конечная щелочность = (2A – B) x 0,1
ПРИМЕР: Образцу требовалось 120 цифр для достижения pH 4,5. Для достижения pH 4 потребовалось еще 15 цифр.2, всего 135 цифр. Следовательно, A = 120 и B = 135.
Двойная конечная щелочность = (240 – 135) x 0,1 = 10,5 мг / л
ПРИМЕР: Образец имел начальное значение pH 4,3. Для понижения pH до 4,0 в образце требовалось 22 цифры. Следовательно, A = 0; B = 22.
Двойная конечная щелочность = (0-22) x 0,1 = -2,2 мг / л
Хотя может показаться, что отрицательное значение щелочности не имеет большого смысла, это чрезвычайно важный показатель для оценки подкисления.
Уход и обслуживание pH-электродаОбщие процедуры ухода за электродами и обращения с ними очень важны в вашей лаборатории, потому что измерения pH будут соответствовать состоянию вашего электрода (-ов). Для большей точности измерений и увеличения срока службы электродов существует несколько областей ухода за электродами, с которыми вам следует ознакомиться.
Хранилище
Стеклянные комбинированные или отдельные электроды pH и сравнения должны оставаться влажными.Для электрода сравнения требуется свободно протекающий спай, поэтому обязательно поддерживайте уровень заполняющего раствора сравнения на уровне, значительно превышающем уровень хранения или раствора образца. Это обеспечит положительное напорное давление, которое вытесняет заполняющий раствор через переход вместо раствора для хранения в зонд.
Для сухого хранения втулка или заглушка должны закрывать заливное отверстие, чтобы уменьшить поток заполняющего раствора. Однако во время измерения или хранения в буфере с pH 4 эту втулку или заглушку необходимо сдвинуть или удалить, чтобы обеспечить поток раствора сравнения в образец.
Для получения более быстрого отклика электрода стеклянный электрод следует хранить в слабокислом растворе. В защитный колпачок стеклянного электрода нанесите одну или две капли буфера с pH 4 и осторожно наденьте колпачок на электрод. Дистиллированная вода извлекает ионы из колбы, вызывая более медленную реакцию; Буфер pH 7 в течение длительного периода времени слегка стареет электрод.
При использовании отдельного электрода сравнения лучшим решением было бы поместить электрод сравнения в его собственный заполняющий раствор, но это может привести к беспорядку.Подача KCl по обеим сторонам соединения делает его более свободным. Чтобы уменьшить солевую корку насыщенного раствора, можно использовать примерно 0,1 М раствор KCl, но только для хранения. Опыт показывает, что в большинстве случаев достаточно просто закрыть заливное отверстие защитным кожухом и хранить в сухом виде при соблюдении процедуры замачивания.
Для комбинированных электродов храните электрод в комбинированном растворе приблизительно 0,1 М KCl в буфере с pH 4.
За день или более до анализа погрузите оба электрода в буфер с pH 4 и во время анализа поместите электроды в тот же буфер, когда они не используются.
Раствор для заполнения электрода сравнения
Внимательно прочтите инструкции, прилагаемые к электродам. Насыщенные каломельные электроды сравнения, такие как те, которые используются в проекте мониторинга кислотных дождей, должны быть заполнены , а не заполняющими растворами, содержащими хлорид серебра (AgCl). Мы используем только растворы 4M KCl.Однако наиболее распространенным раствором для заполнения комбинированных электродов является 4 M KCl, насыщенный AgCl. Убедитесь, что вы выбрали правильный заливочный раствор для вашего электрода (-ов), и дважды проверьте, соответствует ли ваш заполняющий раствор этим требованиям.
Постоянно заполненные или гелевые электроды Из-за их уникального микропористого перехода рекомендуется хранить их в сухом виде.
Предварительное испытание отклика электрода
Если ваш электрод показывает медленный отклик, недостаточный интервал между двумя значениями буфера или чрезмерную чувствительность к перемещению электрода, может потребоваться омоложение для улучшения характеристик.
Отклик зависит от электрода и раствора, в котором он находится. Обычно рабочие электроды достигают 0,05 единиц pH от конечного значения в буфере в течение 10 секунд. Стабильное показание (изменение менее 0,01 единицы pH в минуту) должно быть достигнуто в пробах пресной воды в течение одной или двух минут. Если вам придется ждать слишком долго (5 минут и более), то сам pH может измениться из-за контакта пробы воды с воздухом.
Для электродовможет также потребоваться регулировка наклона до значений, значительно отличающихся от 100% для двухточечной калибровки.Если есть сомнения, выполните следующий тест:
Установите для глюкометра наклон 100% и комнатную температуру, затем выполните стандартизацию, как обычно, с помощью буфера pH 7. Не перемещая шкалу крутизны, считайте буфер pH 4. Оно должно быть от 3,85 до 4,15; установите значение pH 4, наклон должно составлять от 95% до 105%.
Если ваш электрод демонстрирует одну из вышеперечисленных проблем или чувствителен к движению, следует провести омоложение.
Омоложение стеклянным электродом
Для обработки колбы электрода pH:
Используйте по 1 флакону кислоты и основания (0.1N).
БУДЬТЕ ОСТОРОЖНЫ ПРИ ОБРАЩЕНИИ С ЭТИМИ РЕШЕНИЯМИ. ЕСЛИ ВЫ ПОЛУЧИТЕ КАКИЕ-ЛИБО НА ВАС, СМЫЙТЕ БОЛЬШОЙ ВОДОЙ.
- Окуните грушу электрода в кислоту и подождите, пока измеритель не покажет pH ~ 1
- Промойте электрод, затем погрузите его в основание. Подождите, пока глюкометр не покажет pH ~ 13
- Повторите этот цикл ополаскивания и окунания несколько раз (минимум 3 раза, лучше 6 раз)
- Для последнего цикла вы можете оставить электрод в базе на 5 минут, затем ненадолго в кислоте, пока pH не достигнет ~ 1
- Затем промойте электрод водопроводной водой и оставьте на 2 часа в буфере с pH 4.
- Промойте электроды и повторно откалибруйте глюкометр, как вы обычно делаете с буферами pH 7 и pH 4.
Для обработки электрода сравнения:
Замените 4M раствор KCl в электроде сравнения и избавьтесь от кристаллов, которые могли образоваться. Если кристаллов много, встряхните раствор, налейте деионизированную чистую воду в заливное отверстие и погрузите кончик электрода в горячую водопроводную воду на 15 минут или около того, пока кристаллы не растворятся. Затем вытряхните всю жидкость из заливного отверстия электрода сравнения и снова залейте свежим 4 M KCl. Перед использованием дайте электроду постоять при комнатной температуре на полчаса.Часто добавляйте больше 4M раствора KCl к электроду сравнения, так как он будет постоянно вытекать и испаряться. Раствор в электроде должен находиться в пределах ½ дюйма от заливного отверстия. Отверстие должно быть открытым при считывании pH, но закрывать его, когда вы закончите в течение дня, иначе раствор испарится и образуются новые кристаллы (но не закрывайте отверстие, если вы будете хранить электрод в растворе с pH 4). Если у вас все еще есть проблемы с медленным откликом, попробуйте потереть кончиком синие джинсы или очень мелкую (зернистость 600) наждачную бумагу.
Для комбинированных электродов выполните обе процедуры, описанные выше.
Заключительный тест на линейность
Стандартизируйте счетчик, как описано ниже. Промойте электроды и чашку для образцов чистой деионизированной водой. Затем оттитруйте 100,0 мл деионизированной воды 0,16N кислотой следующим образом: Убедитесь, что ваш цифровой титратор работает, и сбросьте его до нуля. Добавьте 10 цифр кислоты, запишите цифры и pH, увеличьте кислотность до 20 цифр, запишите pH; повторяйте, пока не добавите 100 цифр кислоты, и остановитесь.Отправьте нам результаты, и мы отправим вам отчет. Если вы хотите увидеть результаты самостоятельно, попробуйте построить график зависимости концентрации ионов водорода (H = 10 (-pH)) от цифр и посмотреть, прямая ли линия.
Чувствительность движения
Если ваш глюкометр дает дикие показания и чувствителен к прикосновениям, возможно, он не заземлен. Попробуйте использовать трехконтактную вилку или подсоедините провод от счетчика к трубе с холодной водой. Иногда проблему колебания показаний или непротиворечивости показаний можно решить, отсоединив и повторно подключив соединители электродов несколько раз.Очевидно, оксидный слой иногда может вызывать эти симптомы.
Калибровка
pH-метр следует стандартизировать (откалибровать) перед анализом пробы и после каждых 25 анализов проб. Буферы должны быть комнатной температуры (68 ° F). Удалите электроды из буферного раствора с pH 4, в котором они пропитались не менее одного дня. Промыть деионизированной водой. Вставьте электроды в буферный раствор с pH 7,00 и поверните шкалу калибровки до тех пор, пока на глюкометре не отобразится точное значение pH 7,00.Снимите электроды и промойте деионизированной водой. Поместите электроды в буфер с pH 4,01 и отрегулируйте наклон до тех пор, пока измеритель не покажет pH 4,01. Промыть деионизированной водой.
Примечание о буферах . Точность измерения pH напрямую зависит от точности стандартного буферного раствора, используемого для калибровки вашего pH-метра. Чтобы поддерживать разумную степень точности при измерении pH, следует соблюдать ряд мер предосторожности, касающихся ухода за буферами и их использования.К ним относятся:
- Не используйте буферы по истечении срока их действия. Рост плесени, абсорбция CO2 и загрязнение вызывают изменения pH буферного раствора.
- Не используйте буферы, в которых есть плесень.
- Всегда закрывайте емкость с буфером при хранении, чтобы предотвратить загрязнение и уменьшить поглощение CO2.
- Значения pH-буфера изменяются в зависимости от температуры. Обязательно измерьте температуру буфера и найдите его значение при этой температуре перед стандартизацией измерителя (см. Ниже).
- Не наливайте использованный буфер обратно в бутылку.
Значения буфера при различных температурах
| Температура | Буферы | ||
|---|---|---|---|
| ° С | ° F | pH 4 | pH 7 |
| 0 | 32 | 4.003 | 7,119 |
| 5 | 41 | 3,998 | 7.086 |
| 10 | 50 | 3,996 | 7,058 |
| 15 | 59 | 3,996 | 7.035 |
| 20 | 68 | 3.999 | 7.015 |
| 25 | 77 | 4,004 | 7.000 |
| 30 | 86 | 4,011 | 6,998 |
pH Щелочность QA / QC
Контроль качества pH и щелочности состоит из нормального измерения pH и титрования образца, подготовленного WRRC и отправленного вам до сбора на месте.Таких образцов будет три. За несколько дней до отбора проб вы получите от нас первый образец QA / QC вместе с открыткой для отчета о ваших результатах. Это диагностический образец. Следуйте процедурам, описанным для измерения pH и щелочности. Проанализируйте две отдельные аликвоты этого образца и сообщите нам о своих результатах на открытке. Вам позвонят, если мы обнаружим существенное несоответствие между нашими ожиданиями и вашими измерениями. Мы будем работать с вами, чтобы устранить проблему, чтобы вы были уверены в качестве анализа полевых проб.Два других образца QA / QC будут доставлены непосредственно перед отбором образцов в полевых условиях. В отличие от первой выборки QA / QC, они используются для документирования качества данных, помогая нам статистически определять точность и точность вашего анализа. Анализируйте две отдельные аликвоты одной из них непосредственно перед измерением pH и щелочности полевых проб; проанализируйте две отдельные аликвоты второго образца QA / QC сразу после анализа полевых образцов. Другими словами, первые два анализируемых образца должны быть из одной из бутылей QA / QC, затем проанализировать полевые пробы и, наконец, проанализировать две пробы из другой бутылки QA / QC.Результаты должны быть указаны в паспорте лаборатории щелочности pH.
Прогнозирование pH буфера
Прогнозирование pH буфера
PH буфера определяется двумя факторами; 1) константа равновесия слабой кислоты Ka и 2) соотношение от слабого основания [A –] до слабой кислоты [HA] в растворе.
1) Различные слабые кислоты имеют разные константы равновесия (K a ). K a сообщает нам, какая пропорция HA будет диссоциировать на H + и A – в растворе.Чем больше ионов H + создается более кислая и пониженная pH полученного раствора.
2) Отношение A – к HA в буфере также влияет на pH. Если в буфере больше основания, чем кислоты, больше Вероятно присутствие ионов OH – и повышение pH. Если в буфере больше кислоты, чем основания, больше Присутствуют ионы H + , и pH упадет. Когда концентрации A – и HA равны, концентрация H + равна K a , (или эквивалентно pH = pK a ).
Это формализовано уравнением Хендерсона-Хассельбаха:
Поскольку pK a является свойством слабой кислоты, которую мы выбираем для нашего буфера, мы можем контролировать pH, манипулируя соотношение слабого основания (A – ) и слабой кислоты (HA) в растворе.
Когда [A – ] / [HA] остается близким к 1, pH остается близким к pK a . Как указано в [A –] / [HA] от 1/10 до 10 pH изменяется от pK a +1 до pK a -1.Если [A –] / [HA] от 1/10 до 10 pH находится в пределах 1 единицы pKa. Добавление сильной кислоты или основания в буфер изменяет соотношение [A – ] / [HA]. Когда буфер поглощает кислоту (H + ), кислота превращает A – в HA.