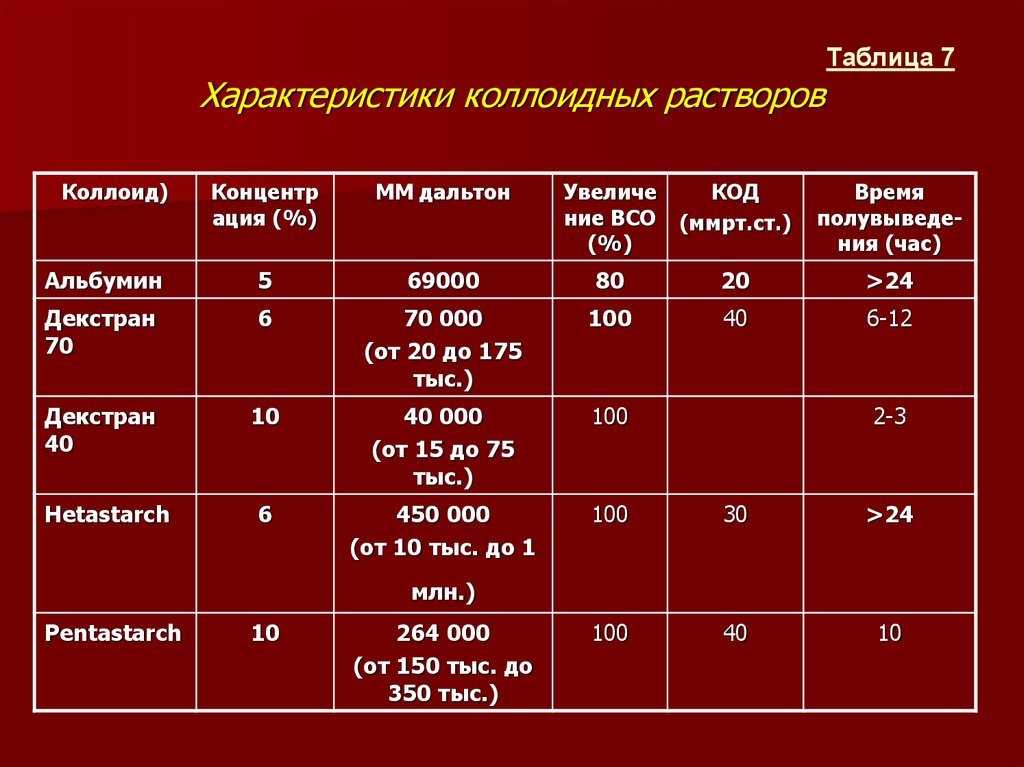
5.2 Количественная характеристика состава растворов
5.2. Количественная характеристика состава растворов
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества).
При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: а) массовая доля растворенного вещества; б) молярная концентрация (молярность).
Массовая доля растворенного вещества
Массовая доля растворённого вещества -это отношение массы растворённого вещества к массе раствора.
Для расчёта процентной концентрации используется формула:
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная
концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля
растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это
означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция
массой 6 г и вода массой 94 г.
Например, массовая доля
растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это
означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция
массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!
Молярная концентрацияМолярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
Единица молярной концентрации – моль/л. Зная число молей вещества в 1 л раствора, легко отмерить нужное количество молей для реакции с помощью подходящей мерной посуды.
В качестве примера рассмотрим получение нерастворимого в воде хлорида серебра (AgCl) с помощью реакции обмена:
AgNO3 + NaCl = AgCl (осадок) + NaNO3
Допустим, в лаборатории имеется раствор AgNO3, концентрация
которого 1 моль/л. Это означает, что в 1 л такого раствора содержится 1 моль
нитрата серебра.
Это означает, что в 1 л такого раствора содержится 1 моль
нитрата серебра.
По уравнению реакции на 1 моль AgNO3 нужен 1 моль NaCl. Следовательно, если мы смешаем одинаковые объемы растворов AgNO3 и NaCl одинаковой концентрации 1 моль/л, то реакция пройдет до конца и в реакционной колбе окажется только раствор нитрата натрия (NaNO3) в воде, а на дно сосуда выпадет осадок хлорида серебра AgCl. При этом исходных соединений в сосуде не останется.
** Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М. Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ. Раствор концентрации 0,1 М содержит 0,1 моль вещества на литр раствора и называется ДЕЦИМОЛЯРНЫМ. Растворы концентрации 0,01 М (или 0,01 моль на литр) иногда называют САНТИМОЛЯРНЫМИ.
УПРАЖНЕНИЯ
1.
Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
1. Запишем формулу для расчёта массовой доли:
2. Преобразуем формулу и вычислим массу растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · mраствора) / 100%
m растворённого вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора =
m (H2O) = m раствора – m растворённого вещества = 300 г – 15 г = 285 г
Ответ: Для приготовления 300 г 5%
раствора надо взять 15 г соли и 285 г воды.
__________________________________________________________________
2.
Сахар массой 12,5г растворили в 112,5г воды.
Определите массовую долю сахара в полученном растворе.
Решение:
1. Запишем формулу для расчёта массовой доли:
2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5 г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г · 100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %
__________________________________________________________________
3.
Смешали два раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. Вычислите массовую долю соли в образовавшемся растворе.
Решение:
1. Запишем формулу для расчёта массовой доли:
2. Преобразуем формулу и вычислим массы растворённого вещества в растворах 1 и 2
4.
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества 1 = (5 % · 120 г) / 100% = 6 г
m растворённого вещества 2 = (15 % · 130 г) / 100% = 19,5 г
2. Общая масса растворённого вещества в полученном растворе:
m растворённого вещества 3 = m растворённого вещества 1+ mрастворённого вещества 2
=6 г + 19, 5 г = 25,5 г 3. Вычислим массу
раствора, полученного при сливании двух растворов:
Вычислим массу
раствора, полученного при сливании двух растворов:
m раствора 3 = m раствора 1 + m раствора 2 = 120 г + 130 г = 250 г
4. Вычислим массовую долю вещества в полученном растворе:
Wр.в. 3= (m р.в. 3 · 100%) /m раствора 3 = (25,5 г · 100%) /250 г = 10,2 %
Ответ: Wр.в. 3 = 10,2 %
__________________________________________________________________
4.
__________________________________________________________________
5.
_____________________________________________________________
6.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли. |
2. Рассчитайте массы соли и воды, необходимые для приготовления 400г раствора с массовой долей соли 0,05. |
| 3. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г воды. |
4. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г соли. |
5. |
6. Вычислите молярную массу вещества, если известно, что в 24л раствора с молярной концентрацией 6 моль/л было растворено 2880 г вещества. |
1. Какие растворы могут находится в контакте с кристаллами растворенного вещества: | |
а) насыщенные | б) разбавленные |
в) все ответы верны | г) концентрированные |
2. Растворимость веществ зависит от: | |
а) их природы | б) природы растворителя |
в) все ответы верны | г) температуры |
3. Какие характеристики применимы для описания истинных растворов: | |
а) однородные системы | б) системы постоянного состава |
в) нет верного ответа | г) неоднородные системы |
4. Растворение хлорида аммония в воде можно отразить схемой NH4Cl(к) + Н2О ↔ NH4Cl(ж) –Q. Растворимость этой соли в воде можно повысить: | |
а) повышая температуру | б) увеличивая степень измельчения соли |
в) увеличения объема воды | г) интенсивным перемешиванием раствора |
5. Интенсивный раствор получается при смешивании между собой по 50 г: | |
а) воды и этанола | б) воды и бензола |
в) воды и бензина | г) воды и карбоната кальция |
6. Какие явления происходят при растворении кристаллического хлорида натрия в воде: | |
а) хаотическое движение гидратированных ионов Na+ и Cl– | б) разрушение кристаллической решетки соли |
в) все ответы верны | г) направленное движение гидратированных ионов соли |
7. Какие утверждения не справедливы для ненасыщенного раствора некоторого вещества: | |
а) может быть разбавленным | б) может быть концентрированным |
в) не может быть концентрированным | г) в таком растворе можно растворить дополнительную порцию этого же вещества |
8. Какие явления отвечают за величину и знак теплового эффекта растворения кристаллических веществ в воде: | |
а) гидрирование | б) разрушение кристаллической решетки вещества |
в) диффузия частиц растворенного вещества в воде | г) все ответы верны |
9. При растворении в воде массой 36 г медного купороса массой 5 г получается раствор с массовой доле CuSO4 (%): | |
а) 8,7 | б) 9,8 |
в) 7,8 | г) 6,8 |
10. В 100 мл воды растворили 2 г CaCl2. Какова масса (г) ионов Са2+ в 20 мл такого раствора (изменением объема при растворении можно пренебречь): | |
а) 0,400 | б) 0,444 |
в) 0,144 | г) 0,288 |
Ответы:
1 | в |
2 | в |
3 | а |
4 | а |
5 | а |
6 | в |
7 | в |
8 | б |
9 | в |
10 | в |
Общая характеристика растворов | Подготовка к ЦТ и ЕГЭ по химии
25 Ноя
Posted on Author admin 0
Чтобы поделиться, нажимайте
Растворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя.
Любой раствор состоит по меньшей мере из двух веществ, одно из которых считается растворителем, а другое — растворенным веществом. Растворителем считается компонент, агрегатное состояние которого такое же, как и агрегатное состояние раствора. Деление это довольно условно, а для веществ, смешивающихся в любых соотношениях (вода и ацетон, золото и серебро), лишено смысла. В этом случае растворителем считается компонент, находящийся в растворе в большем количестве.
Состав растворов может меняться в довольно широких пределах, в этом растворы сходны с механическими смесями. По другим признакам, таким как однородность, наличие теплового эффекта и окраски растворы сходны с химическими соединениями.
Растворы могут существовать в газообразном, жидком или твердом агрегатном состоянии. Воздух, например, можно рассматривать как раствор кислорода и других газов в азоте; морская вода — это водный раствор различных солей в воде. Металлические сплавы относятся к твердым растворам одних металлов в других.
Растворение веществ является следствием взаимодействия частиц растворяемого вещества и растворителя. В начальный момент времени растворение идет с большой скоростью, однако по мере увеличения количества растворенного вещества возрастает скорость обратного процесса – кристаллизации. Кристаллизацией называется выделение вещества из раствора и его осаждение. В какой-то момент скорости растворения и осаждения сравняются и наступит состояние динамического равновесия.
Раствор, в котором вещество при данной температуре уже больше не растворяется, или иначе, раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. Для большинства твердых веществ растворимость в воде увеличивается с повышением температуры. Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы, то образуется пересыщенный раствор. Пересыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации – кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли.
Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации – кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли.
Раствор, содержащий меньше растворенного вещества, чем насыщенный, называется ненасыщенным раствором.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Характеристики, свойства, типы и часто задаваемые вопросы
Смесь – это материал, состоящий из еще двух химических соединений или веществ, которые не объединяются химически. На самом деле это физическая комбинация двух или более веществ, которые способны сохранять идентичность при смешивании в виде растворов, суспензий или коллоидов. Разделить их можно физическими методами. В любой смеси различные компоненты не образуются в результате каких-либо химических изменений. Таким образом, индивидуальные свойства компонентов остаются неизменными.
На самом деле это физическая комбинация двух или более веществ, которые способны сохранять идентичность при смешивании в виде растворов, суспензий или коллоидов. Разделить их можно физическими методами. В любой смеси различные компоненты не образуются в результате каких-либо химических изменений. Таким образом, индивидуальные свойства компонентов остаются неизменными.
Другими словами, смесь — это то, что получается при соединении двух веществ таким образом, что между веществами не происходит химической реакции, и их можно разделить еще раз. В смеси каждый компонент сохраняет свою химическую идентичность. Можно понять, что смеси являются продуктом механического смешивания элементов или соединения, в котором не происходит химической связи, и химические свойства всех элементов, участвующих в процессе смешивания, сохраняют свои собственные химические свойства и состав. Обычно механическое смешивание объединяет компоненты смеси, смесь может быть получена с помощью различных процедур (например, диффузии, осмоса).
Несмотря на то, что компонент смеси остается неизменным, смесь может иметь неожиданные физические свойства по сравнению с обоими ее компонентами. Например, если вы соедините спирт и воду, смесь будет иметь другую точку плавления и точку кипения, чем любой из компонентов.
Несколько примеров смесей, которые мы встречаем в нашей повседневной жизни.
Песок и вода
Соль и вода
Сахар и соль
Этанол в воде
AIR
Сода
Соль и перец
Несколько примеров, которые мы находим в наших повседневных жизнях, которые не являются микшированными.
Пищевая сода и уксус.
Бура и клей для приготовления слизи.
Смешайте вместе соляную кислоту (HCl) и гидроксид натрия (NaOH).
Наконец, состав вещества с точки зрения смеси можно разделить на два варианта, а именно:-
Свойства и характеристики смесей
Свойства смесей следующие:
Первоначальные физические и по существу химические свойства веществ остаются неизменными без каких-либо изменений.
Отделение веществ от смеси может быть легко осуществлено, поскольку это всего лишь процесс механического смешивания.
Пропорции, в которых растворяются вещества, различны.

Характеристики смеси следующие:-
Два или более вещества существуют вместе, несмотря на отсутствие силы, действующей между ними.
Вещества в смеси бывают гомогенными или гетерогенными по своей природе.
Пропорции веществ, присутствующих в смеси, варьируются в неопределенном порядке.
Свойства отдельных компонентов определяют свойства смеси.
Физический метод является ключом к разделению веществ, растворенных в смесях.
Характеристики веществ определяют температуру кипения и плавления смеси.
При образовании смеси энергия не изменяется.

Все вещества в твердом, жидком или газообразном состоянии могут объединяться, образуя смесь.
Утверждение и смеси
Как видно из самого термина, смесь представляет собой смешение двух или более веществ. Обвинение позволяет нам определить пропорцию, в которой ингредиенты/предметы действительно были смешаны, и по какой цене они предлагаются для получения прибыли или ущерба.
Типы смесей
В зависимости от состава смесей их можно разделить на два типа:
Однородные смеси
Смеси, имеющие однородный состав по всему веществу, называются гомогенными смесями. Например – смесь соли и воды, смесь сахара и воды, воздух, лимонад, безалкогольная вода и так далее. Здесь классическим примером является смесь соли в воде. Это на том основании, что здесь граница между солью и водой никогда не может быть разделена. В момент, когда луч света падает на смесь соли и воды, путь света не виден.
В момент, когда луч света падает на смесь соли и воды, путь света не виден.
Свойства гомогенных смесей
Все растворы являются примерами гомогенной смеси.
Размер частиц в таком случае составляет менее одного нанометра.
Они не демонстрируют влияния Тиндаля.
Нельзя разделить границы частиц.
Здесь невозможно разделить составные частицы с помощью центрифугирования или декантации.
Сплавы — это экземпляры решения.
Гетерогенная смесь
Смеси, которые не являются однородными на всем протяжении, называются гетерогенными смесями. В этом смысле смесь почвы и песка, серы и железных опилок, нефти и воды и т. д. неоднородна, так как не имеет однородного состава. Это на том основании, что в таком случае он имеет две или более различных фаз.
В этом смысле смесь почвы и песка, серы и железных опилок, нефти и воды и т. д. неоднородна, так как не имеет однородного состава. Это на том основании, что в таком случае он имеет две или более различных фаз.
Свойства гетерогенных смесей
Большинство смесей неоднородны, за исключением растворов и сплавов.
Составляющие частицы здесь неоднородны.
Вы можете эффективно различать компоненты.
Как правило, в гетерогенной смеси доступно не менее двух стадий.
Размер частиц здесь находится в диапазоне от одного нанометра до одного микрометра.
Они демонстрируют удар Тиндаля.

Разделение смесей
Различные компоненты смеси иногда можно разделить на независимые единицы. Некоторые методы разделения смесей перечислены ниже:
Фильтрация. Этот метод можно использовать для отделения нерастворимых материалов, таких как песок, смешанный с водой. Смесь можно выливать через фильтровальную бумагу; однако твердое вещество действительно останется позади, потому что оно не может течь через бумагу, в то время как жидкость течет.
Испарение (простая дистилляция) – При кипячении смеси вода испаряется, оставляя после себя растворенное растворимое вещество.
Конденсация. Конденсация представляет собой метод перехода воды из газообразной или парообразной фазы в жидкую фазу. Конденсация – это метод, который приводит к образованию облаков.

Магнетизм. Можно разделить магнитные объекты, проведя магнитом по группе металлических объектов.
Декантация – используется для разделения смесей, таких как масло в воде. В контейнер смесь сначала выливается, после того как жидкость оседает, жидкости затем можно должным образом разделить, осторожно сливая верхний слой, как только они образовали два отдельных слоя в результате своего движения.
Разделение по размеру частиц
В зависимости от размера частиц компонентов или веществ смеси подразделяются на растворы, коллоиды и суспензии.
1. Раствор
Раствор содержит мельчайшие частицы размером менее 1 нанометра. Компоненты раствора нельзя выделить центрифугированием или декантацией смеси. Примером этого является воздух.
2. Коллоиды
Коллоидная смесь без увеличения выглядит однородной, однако при рассмотрении под микроскопом; вы можете видеть, что это не однородная смесь. Размеры молекул коллоидов от 1 нанометра до 1 микрометра. Различные вещества в коллоиде можно разделить с помощью центрифуги. Случай коллоида – это лак для волос, в котором жидкость находится в воздухе и объединяется с газом.
Размеры молекул коллоидов от 1 нанометра до 1 микрометра. Различные вещества в коллоиде можно разделить с помощью центрифуги. Случай коллоида – это лак для волос, в котором жидкость находится в воздухе и объединяется с газом.
3. Суспензия
Суспензия имеет более крупные частицы, чем две указанные выше смеси. Иногда смесь кажется неоднородной. Суспензии содержат стабилизаторы, препятствующие нормальной изоляции частиц друг от друга. Как декантация, так и центрифугирование позволяют выделить компоненты суспензий. Случай суспензии – это порция заправки для салата с уксусом и водой. Более тяжелое вещество перевязочного материала изолируется и идет к основанию отсека, а вода стекает, чтобы все закончить.
Несколько простых фактов о смесях
Дым представляет собой смесь взвешенных в воздухе частиц.
Водопроводная вода представляет собой смесь воды и других частиц.
 Чистую воду или h3O обычно называют дистиллированной водой.
Чистую воду или h3O обычно называют дистиллированной водой.Многие из веществ, с которыми мы соприкасаемся каждый день, представляют собой смеси, включая воздух, которым мы дышим, который представляет собой смесь газов, таких как кислород и азот.
Кровь представляет собой смесь, которую можно разделить с помощью машины, называемой центрифугой, на две основные части: плазму и эритроциты.
Заключение
Можно сделать вывод, что смесь представляет собой механическое смешивание двух или более компонентов при сохранении их отличительных характеристик. Он может принимать форму растворов, суспензий или коллоидных частиц. Химические компоненты и соединения, среди прочего, могут быть механически смешаны или смешаны для создания смесей, но при этом не происходит химического связывания или другого типа химического преобразования, поэтому каждый компонент сохраняет свои уникальные химические характеристики. В этой статье также рассказывается о различных типах смесей, принципе смесей и различных методах, используемых при разделении смесей.
В этой статье также рассказывается о различных типах смесей, принципе смесей и различных методах, используемых при разделении смесей.
Вопросы с несколькими вариантами ответов
1. Что из следующего является примером химической смеси?
Соединение, состоящее из различных элементов.
Вещество, полученное посредством химической связи.
Когда два вещества объединены, но не связаны химически.
Все вышеперечисленное.
Ничего из вышеперечисленного.
Ответ: с
2. Молоко представляет собой смесь, называемую ……………….
сплав
Решение
Соединение
Коллоид
Подвеска
ANS: D D
3. A Mixture Between a Liquid and a Solid in Which the Solid Does Not Dissolve:
A Mixture Between a Liquid and a Solid in Which the Solid Does Not Dissolve:
Alloy
Solution
Compound
Colloid
Suspension
Ответ: е
4. Steel is a Type of Mixture Called………………
Alloy
Solution
Compound
Colloid
Suspension
Ans: a
5. Выберите истинное утверждение
Выберите истинное утверждение
Решения представляют собой гетерогенные смеси.
Раствор – это разновидность смеси.
Все смеси являются растворами.
Все вышеперечисленное.
Ничего из вышеперечисленного.
Ответ: б
6. Какое утверждение о смесях и растворах верно?
Растворы представляют собой гетерогенные смеси.
Раствор – это разновидность смеси.
Все смеси являются растворами.

Все вышеперечисленное.
Ничего из вышеперечисленного.
Ответ: с
7. Что представляет собой соленая вода?
сплав
Подвеска
Решение
Коллоид
Гетерогенный
ANS: c
8. Как называется вещество, растворяющееся в растворе?
Растворитель
Сплав
Суспензия
Растворитель
Коллоид
Ответ: д
9. Тип смеси, в которой вещества равномерно распределены по всей смеси?
Тип смеси, в которой вещества равномерно распределены по всей смеси?
Однородный.
Неоднородный.
Все виды смесей.
Нет типов смесей.
Ответ: а
10. Что из следующего неверно?
Компоненты легко отделяются друг от друга.
Первоначальные свойства комбинированных веществ изменены.
Соотношение компонентов может варьироваться.
Сочетание двух или более веществ.
Все вышеперечисленное.

Ответ: b
3.5: Различия в физических и химических свойствах вещества
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47458
Цели обучения
Отделить физические свойства от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1. 035 035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| кукурузное масло | 0,922 |
| майонез | 0,910 |
| мед | 1,420 |
Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, после изучения химии в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физические свойства | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C. | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.

- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Решение
«Железо разъедает во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- в
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества.

 Вычислите молярную концентрацию
раствора поваренной соли, если в 500 мл этого раствора содержится 0,5 моль
хлорида натрия.
Вычислите молярную концентрацию
раствора поваренной соли, если в 500 мл этого раствора содержится 0,5 моль
хлорида натрия.




 Чистую воду или h3O обычно называют дистиллированной водой.
Чистую воду или h3O обычно называют дистиллированной водой.