HI6010 буферный раствор pH 10.010 ± 0.002 при 25°C
Артикул: HI6010
Производитель: Hanna Instruments
Наличие: Под заказ
Заказать Добавить в сравнение
HI6010 представляет собой буферный раствор с высокой точностью pH 10,010 ± 0.002 при 25°C. Предназначен для калибровки pH электродов. Объем флакона 500 мл.
HI6010 поставляется с сертификатом анализа. Калибровочные буферы Hanna содержат информацию о номере партии и дату истечения срока годности на этикетке.
Герметичность упаковки обеспивает качество и свежесть раствора. Непрозрачный флакон предотвращает любое окисление под действием УФ-излучения, которое может изменить pH значение буфера.
Сертифицированный стандартный буферный раствор, pH 1,679
Артикул: S11M001
Сертифицированный стандартный буферный раствор, pH 4,005
Артикул: S11M002
Сертифицированный стандартный буферный раствор, pH 6,865
Артикул: S11M003
Характеристики Рекомендуемые товары
Характеристики
Характеристики
| Тип | Растворы со стандартным pH |
| Индустрия | Еда и напитки, Муниципальная |
| Параметры | pH |
| Диапазон Измерений | pH 10,010 |
| Объём | 500 мл |
Рекомендуемые товары
pH Буферный раствор, pH 7,00 Желтый
Готовый буферный раствор в бутылочке, концентрация 7,00 ± 0. 02 pH, Желтый, 500 мл.
02 pH, Желтый, 500 мл.
Артикул: 2283549.99
Посмотреть товар Сравнить
Буфер pH 4,01 и pH 7,00 в порошке Powder Pillows 2 x 15 шт.
Буфер pH в виде порошка для разбавления для калибровки pH метра. Индивидуальные герметичные пакетики.
Артикул: 2299264
Посмотреть товар Сравнить
Сертифицированный стандартный буферный раствор, pH 12,45
Сертифицированный стандартный буферный раствор, pH 12,45 ±0,05 при 25°C, 500 мл.
Артикул: S11M008
Посмотреть товар Сравнить
HI70004P Раствор буферный pH 4.01 для калибровки pH метров (25 x 20 мл)
HI70004P содержит 25 пакетиков, содержащих 20 мл буферного раствора для калибровки pH метров и электродов.
Артикул: HI70004P
Посмотреть товар Сравнить
30458274 буферный раствор pH 1,679
Калибровочный раствор со значением pH 1,679. Флакон 250 мл.
Флакон 250 мл.
Артикул: 30458274
Посмотреть товар Сравнить
Сертифицированный стандартный буферный раствор, pH 6,865
Сертифицированный стандартный буферный раствор, pH 6,865 ±0,010 при 25°C, 500 мл.
Артикул: S11M003
Посмотреть товар Сравнить
HI6004 калибровочный раствор pH 4.010 ± 0.002 при 25°C
HI6004 представляет собой калибровочный буфер с pH 4,010 +/- 0,002 pH.
Артикул: HI6004
Посмотреть товар Сравнить
Сертифицированный стандартный буферный раствор, pH 1,679
Сертифицированный стандартный буферный раствор, pH 1,679 ±0,010 при 25°C, 500 мл.
Артикул: S11M001
Посмотреть товар Сравнить
Буферные растворы pH Singlet одноразового использования, pH 4,01 и 7,00
Буферные растворы Singlet в индивидуальных герметичных пакетиках, с цветовой кодировкой. pH составляет 4,01 и 7,00 ±0.02 pH при 25°C. Упаковка: 20 штук по 20 мл каждая.
pH составляет 4,01 и 7,00 ±0.02 pH при 25°C. Упаковка: 20 штук по 20 мл каждая.
Артикул: 2769920
Посмотреть товар Сравнить
108702 WTW TEP 7: Технический буферный раствор, pH 7,00 (1 литр)
Буферный раствор для калибровки pH метров. Стандартное значение pH буфера – 7,00.
Артикул: 108702
Посмотреть товар Сравнить
51350026 Технический буферный раствор pH 11,00, 6 x 250 мл
Упаковка содержит 6 флаконов с буферным раствором по 250 мл.
Артикул: 51350026
Посмотреть товар Сравнить
51302070 Буфер pH 9.21 в пакетиках 30×20 мл
Одноразовые пакетики с pH буфером от Mettler Toledo. Раствор заливается в упаковку при контролируемых условиях, гарантируя свежий и чистый раствор для каждой калибровки pH электрда.
Артикул: 51302070
Посмотреть товар Сравнить
Буфер Powder Pillows, pH 6. 86, 15 шт.
86, 15 шт.
Буфер для калибровки pH метра в виде порошка для разведения.
Артикул: 1409895
Посмотреть товар Сравнить
pH Буферный раствор, pH 4,01 Красный
Готовый буферный раствор в бутылочке, концентрация 4,01 ± 0.02 pH, Красный, 500 мл.
Артикул: 2283449.99
Посмотреть товар Сравнить
HI70007P калибровочный раствор pH 7.01, пакетики 25 x 20 мл
Буферный раствор со значением pH 7.01 для калибровки pH метров и электродов. Упаковка содержит 25 пакетиков с 20 мл раствора.
Артикул: HI70007P
Посмотреть товар Сравнить
51302068 Набор pH буферов Rainbow I
Набор калибровочных растворов pH в пакетиках для одноразового использования.
Артикул: 51302068
Посмотреть товар Сравнить
HI7010L буферный раствор pH 10.01, объем 500 мл
Буферный раствор с pH 10,01 обычно используется для калибровки оборудования, используемого для анализа образцов воды и прочих жидкостей.
Артикул: HI7010L
Посмотреть товар Сравнить
Калибровочный раствор ph 10.01, 250 мл
Буферный раствор pH 10,01 ± 0,02 pH при 25°C для проверки точности работы pH-метров и электродов.
Артикул: LZW9471.99
Посмотреть товар Сравнить
Сертифицированный стандартный буферный раствор, pH 4,005
Сертифицированный стандартный буферный раствор, pH 4,005 ±0,010 при 25°C, 500 мл.
Артикул: S11M002
Посмотреть товар Сравнить
Калибровочный раствор ph 7.00, 250 мл
Буферный раствор для калибровки и проверки точности pH электродов и измерителей ионов водорода, pH составляет 7,00 ± 0,02 pH при 25°C
Артикул: LZW9464.98
Посмотреть товар Сравнить
51350032 Сертифицированный буферный раствор pH 4,01, 250 мл
Калибровочный раствор с цветовой кодировкой для pH электродов.
Артикул: 51350032
Посмотреть товар Сравнить
HI7007L буферный раствор pH 7.01, объем 500 мл
рН 7,01 является наиболее широко используемым значением среди всех буферных растворов.
Артикул: HI7007L
Посмотреть товар Сравнить
HI770710P Пакетики с буфером pH 7,01 и 10,01 (набор)
Hабор калибровочных буферных растворов с pH 7,01 и 10,01 +/- 0,01 pH при 25°C.
Артикул: HI770710P
Посмотреть товар Сравнить
30464127 Буферный раствор pH 12,454
Буферный раствор со значением pH 12,454 ± 0,05
Артикул: 30464127
Посмотреть товар Сравнить
Рекомендуемые товары
30458274 буферный раствор pH 1,679
Калибровочный раствор со значением pH 1,679. Флакон 250 мл.
Артикул: 30458274
Посмотреть товар Сравнить
Калибровочный раствор ph 10. 01, 250 мл
01, 250 мл
Буферный раствор pH 10,01 ± 0,02 pH при 25°C для проверки точности работы pH-метров и электродов.
Артикул: LZW9471.99
Посмотреть товар Сравнить
Буферный раствор pH 7,00 25 мл.
Раствор для калибровки pH метра без цветовой кодировки.
Артикул: 1222220
Посмотреть товар Сравнить
51350010 Буферный раствор pH 10,00, 250 мл
Технический буферный раствор для калибровки ph метров и электродов.
Артикул: 51350010
Посмотреть товар Сравнить
HI77100P калибровочные растворы 1413 мкСм/см и pH 7,01 в пакетиках
HI77100P — это набор высококачественных стандартов проводимости 1413 мкСм/см и буферов pH 7,01 в удобных для использования одноразовых пакетиках.
Артикул: HI77100P
Посмотреть товар Сравнить
Буферные растворы pH Singlet одноразового использования, pH 10,01
Буферные растворы Singlet в индивидуальных герметичных пакетиках, с цветовой кодировкой. pH составляет 10,01 ±0.02 pH при 25°C. Упаковка: 20 штук по 20 мл каждая.
pH составляет 10,01 ±0.02 pH при 25°C. Упаковка: 20 штук по 20 мл каждая.
Артикул: 2770220
Посмотреть товар Сравнить
Буферный раствор pH 10,01, 125 мл
Калибровочный раствор с pH 10,01 ± 0,02 при 25 °C для ph-электродов.
Артикул: LZW9470.99
Посмотреть товар Сравнить
51302068 Набор pH буферов Rainbow I
Набор калибровочных растворов pH в пакетиках для одноразового использования.
Артикул: 51302068
Посмотреть товар Сравнить
Пакетики Powder Pillows с буфером в порошке, pH 10,01 (синий) 15 шт
Герметичные пакетики с порошком для калибровки pH электрода.
Артикул: 2227195
Посмотреть товар Сравнить
Объем – буферный газ – Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Схема распределения газа в подземном хранилище. | Индикаторные кривые.
[31] | Индикаторные кривые.
[31] |
Критерием для определения базисного давления в этом случае является экономическая оценка наивыгоднейшего сочетания базисного давления степени компри-мнрования газа и объема буферного газа. [32]
Объем буферного газа кроме технологических факторов зависит от капитальных вложений в бурение скважин, эксплуатационных затрат при их работе, стоимости единицы
Объем буферного газа кроме технологических факторов зависит от капитальных затрат на бурение скважин, эксплуатационных расходов при их работе, стоимости единицы объема буферного газа и эксплуатационных расходов на его закачку и восполнение, капитальных затрат на строительство компрессорной станции и эксьлуатационных расходов при ее работе. [34]
Объем буферного газа кроме технологических факторов зависит от капитальных вложений в бурение скважин, эксплуатационных затрат при их работе, стоимости единицы объема буферного газа и эксплуатационных затрат на его закачку и восполнение, капитальных вложений в строительство КС и эксплуатационных затрат на ее работу. [35]
[35]
Увеличение радиуса скважин, гидродинамически совершенных по степени и характеру вскрытия пласта при постоянной максимально допустимой скорости фильтрации на поверхности забоя скважин, приводит к пропорциональному увеличению их дебита, уменьшению числа скважин, что в свою очередь влияет на объем буферного газа и мощность КС. [36]
Параметры технологических режимов в процессе закачки, хранения и отбора газа рассчитываются на стадии проектирования. Проектом определяются объемы активного и буферного газа, продолжительность режимов закачки, хранения и отбора газа, периодичность циклов, производительность закачки и отбора газа и другие показатели, необходимые для эффективной эксплуатации хранилища. [37]
В статье приводится решение оптимизационной задачи проектирования подземного хранилища газа в истощенном месторождении. Указаны два метода выбора оптимального количества скважин, их конструкции, числа компримируащих агрегатов КС и объема буферного газа. [38]
[38]
| Схема распределения газа в подземном хранилище.| Индикаторные кривые. [39] |
При нормальной эксплуатации подземного хранилища весь объем газа, исключая буферный газ, может быть отобран из пласта. Но это не значит, что в некоторых непредвиденных случаях нельзя отобрать дополнительное количество газа с понижением объема буферного газа. [40]
При работе ПХГ, созданных в ловушках водонасыщенных пластов, вода может существенно вторгаться в ранее газонасыщенный объем порового пространства хранилища, не полностью вытесняя газ из обводняемого объема. При этом обводняется до 70 % начального газонасыщенного объема хранилища и в зоне обводнения остается свыше 45 % объема буферного газа. [41]
Изложена методика непрерывного мониторинга запасов газа, хранимого в ПХГ, контроля его сохранности и оперативного выявления возможных утечек и прочих потерь газа. Простое суммирование объемов закачек газа в пласт и его отборов из пласта дает лишь книжный или бухгалтерский остаток, т.е. объем буферного газа, который должен был бы находиться в пласте ПХГ к данному моменту времени. Невыявленные утечки газа или его уходы за пределы купольной ловушки могут привести к существенным отличиям истинного количества газа, находящегося в хранилище, от числящегося остатка. Задача состоит в том, чтобы по эксплуатационным данным, т.е. по данным об изменениях давления в пласте и соответствующих им объемам закачек ( и отборов) газа оценить количество буферного газа, находящегося в том или ином ПХГ на текущий момент времени.
[42]
Простое суммирование объемов закачек газа в пласт и его отборов из пласта дает лишь книжный или бухгалтерский остаток, т.е. объем буферного газа, который должен был бы находиться в пласте ПХГ к данному моменту времени. Невыявленные утечки газа или его уходы за пределы купольной ловушки могут привести к существенным отличиям истинного количества газа, находящегося в хранилище, от числящегося остатка. Задача состоит в том, чтобы по эксплуатационным данным, т.е. по данным об изменениях давления в пласте и соответствующих им объемам закачек ( и отборов) газа оценить количество буферного газа, находящегося в том или ином ПХГ на текущий момент времени.
[42]
Объем буферного газа составляет от 60 до 140 % рабочего газа. Затраты на буферный газ и его закачку в ПХГ эквивалентны капитальным вложениям при сооружении ПХГ. Объем буферного газа, число эксплуатационных скважин и мощность КС взаимосвязаны. [43]
Фактором, определяющим выбор величины базисного давления, может служить максимальный суточный отбор газа из хранилищ в конце отопительного сезона, когда пластовое давление приближается к базисному. Однако проблема обеспечения потребителей газом в этот период может быть решена также бурением дополнительных скважин. Поэтому необходимо сравнивать затраты на бурение этих скважин с затратами на увеличение объема буферного газа.
[44]
Однако проблема обеспечения потребителей газом в этот период может быть решена также бурением дополнительных скважин. Поэтому необходимо сравнивать затраты на бурение этих скважин с затратами на увеличение объема буферного газа.
[44]
Объем буферного газа составляет от 60 до 140 % рабочего газа. В США на долю буферного газа в среднем приходится до 32 % общих затрат. Стоимость его включается в амортизационные затраты. Объем буферного газа, число эксплуатационных скважин и мощность КС взаимосвязаны друг с другом. [45]
Страницы: 1 2 3 4
ChemTeam: буферы и уравнение Хендерсона-Хассельбальха: задачи № 21
ChemTeam: буферы и уравнение Хендерсона-Хассельбаха: задачи № 21–30Буферы и уравнение Хендерсона-Хассельбальха
Задачи №21–30
| Пятнадцать примеров буфера | Проблемы с буфером 1–10 | Проблемы с буфером 11–20 | Проблемы с буфером 31–40 |
Введение. к уравнению Хендерсона-Хассельбальха к уравнению Хендерсона-Хассельбальха | Вернуться в меню «Кислотно-основное» | ||
Задача № 21: Какой объем 6,00 М NaOH нужно добавить к 0,250 л 0,300 М HNO 2 , чтобы приготовить буфер с рН = 4,00?
Решение:
1) Первое, что нужно сделать, это найти K a для азотной кислоты, чтобы найти:
4,0 x 10¯ 4Можно найти несколько различных значений. Я выбрал тот, что выше, так как он казался более распространенным, чем другие.
2) Некоторые комментарии по химическому составу:
Мы знаем, что будет происходить такая реакция:HNO 2 + OH¯ —> H 2 O + NO 2 ¯Гидроксид ДОЛЖЕН быть ограничивающим реагентом. Почему? Если бы осталось немного NaOH, раствор был бы смесью сильного основания (NaOH) и некоторого количества NaNO 2 (соль слабой кислоты).
Это НЕ буфер, и pH будет рассчитываться с использованием концепции сильного основания.
Таким образом, окончательным раствором будет смесь HNO 2 и NO 2 ¯. Поскольку этот раствор является буфером, будет использовано уравнение Хендерсона-Хассельбаха.
3) Заполнение H-H, шаг 1:
pH = pK a + log [основание/кислота]Мы знаем, что у нас должен быть буфер с pH = 4,00:
4,00 = pK a + log [основание/кислота]
4) Заполнение H-H, шаг 2:
4,00 = 3,40 + log [основание/кислота]3.40 это pK a для HNO 2 .
5) Заполнение H-H, шаг 3:
Я дам вам часть журнала, а затем прокомментирую ее:
х 4,00 = 3,40 + log –––––––––– 0,0750 − х Неизвестный ‘x’ – это количество NO 2 ¯, полученное в результате реакции HNO 2 с OH¯.
Часть 0,0750 от (0,0750 − x) получается из этого расчета:
(0,300 моль/л) (0,250 л) = 0,0750 моль, а «х» — количество молей прореагировавшей HNO 2 . Сумма потерянного HNO 2 равна сумме полученного NO 2 ¯.
6) Алгебра!
4,00 = 3,40 + log [х / (0,0750 – х)]log [х / (0,0750 – х)] = 0,60
х / (0,0750 – х) = 3,98
х = 0,2985 – 3,98х
4,98х = 0,2985
x = 0,05994 моль При молярном соотношении 1:1 общей реакции это количество молей гидроксида, которое необходимо добавить.
7) Определите необходимый объем раствора гидроксида натрия:
0,05994 моль / 6,00 моль/л = 0,00999 лИсходя из значения K a , 2 сиг инжира кажутся лучшими —> 10 мл
Задача № 22: Если планируется приготовить ацетатный буферный раствор путем нейтрализации УВ 2 H 3 O 2 с помощью 0,10 М NaOH, какой объем (в мл) 0,10 М NaOH потребуется для добавить к 10,0 мл 0,10 М HC 2 H 3 O 2 для приготовления раствора с pH = 5,50?
Решение:
Комментарий: При работе с солью (ацетатом натрия) и кислотой (уксусной кислотой) я буду использовать моли, а не молярность. Поскольку все происходит в одном и том же объеме раствора, отношение молей соли к молям кислоты такое же, как и отношение молярностей. Кроме того, мы не знаем конечную молярность, так как добавляем неизвестный объем раствора NaOH.
Поскольку все происходит в одном и том же объеме раствора, отношение молей соли к молям кислоты такое же, как и отношение молярностей. Кроме того, мы не знаем конечную молярность, так как добавляем неизвестный объем раствора NaOH.
1) Нам нужно знать начальные моли уксусной кислоты в растворе:
(0,010 л) (0,1 моль/л) = 0,001 моль
2) Подставим значения в уравнение H-H:
pH = pK a + log [основание/кислота]5,50 = 4,752 + log [х / (0,001 – х)]
4.752 pK a уксусной кислоты
x – количество молей ацетата натрия, полученное в результате реакции NaOH.
0,001 − x — количество оставшейся в растворе уксусной кислоты.Моли ацетата дадут нам моли NaOH, так как молярное соотношение между ними составляет 1:1.
3) Продолжить решение:
log (х / 0,001 – х) = 0,748
4) Антилог с обеих сторон
(х / 0,001 – х) = 5,598
5) Перемножить и упростить, чтобы получить:
6,598x = 5,598 x 10¯ 3x = 8,5 x 10¯ 4 молей
6) Определим требуемый объем NaOH:
8,5 x 10¯ 4 моль разделить на 0,1 моль/л = 8,5 x 10¯ 3 л = 8,5 мл
Задача №23: Стакан со 175 мл уксуснокислого буфера с рН 5000 стоит на столешнице. Общая молярность кислоты и сопряженного основания в этом буфере составляет 0,100 М. Студент добавляет в химический стакан 8,40 мл 0,300 М раствора HCl. Что такое новый рН? pK a уксусной кислоты составляет 4,752.
Общая молярность кислоты и сопряженного основания в этом буфере составляет 0,100 М. Студент добавляет в химический стакан 8,40 мл 0,300 М раствора HCl. Что такое новый рН? pK a уксусной кислоты составляет 4,752.
Решение:
1) Используйте Henderson-Hasselbalch, чтобы получить молярность основания и кислоты:
pH = pK a + log [основание/кислота]5,000 = 4,752 + log [х / (0,1 – х)]
Обратите внимание, что x и 0,1 − x в сумме дают 0,1, то есть общую молярность
log [х / (0,1 – х)] = 0,248
[х / (0,1 – х)] = 1,7701
х = 0,17701 – 1,7701х
2,7701x = 0,17701
х = 0,0639 М 0,1 – 0,0639 = 0,0361
2) Теперь нам нужно узнать количество молей уксусной кислоты, ацетата и HCl:
ацетат —> (0,0639 моль/л) (0,175 л) = 0,0111825 моль
уксусная кислота —> (0,0361 моль/л) (0,175 л) = 0,0063175 моль
HCl —> (0,300 моль/л) (0,00840 л) = 0,00252 моль3) HCl будет реагировать с ацетатом и превращать его в уксусную кислоту.
Количество ацетата уменьшается, а количество уксусной кислоты увеличивается. Обратите внимание, что все стехиометрии реакции равны 1:1.
ацетат —> 0,0111825 моль − 0,00252 моль = 0,0086625 моль
уксусная кислота —> 0,0063175 моль + 0,00252 моль = 0,0088375 моль4) Теперь снова для уравнения HH:
pH = 4,752 + log (0,0086625 / 0,0088375)pH = 4,752 + log 0,98019802
рН = 4,752 + (-0,009)
pH = 4,743
Задача № 24: 200,0 мл ацетатно-уксусного буфера имеют общую молярность 0,100 М и рН 5,000. Каково новое значение рН после добавления 6,30 мл 0,490 М HCl?
Решение:
1) Нам нужно было узнать количество уксусной кислоты (HAc) и ацетат-иона (Ac¯) в буфере с pH 5:
pH = pK a + log [основание/кислота]5,000 = 4,752 + log [х / (0,02 – х)]
0,02 происходит от:
МЗ = (0,100 моль/л) (0,2000 л) = 0,0200 мольlog [х / (0,02 – х)] = 0,248
х / (0,02 – х) = 1,770109
х = 0,03540218 – 1,770109 х
2,770109x = 0,03540218
х = 0,01278 моль 0,02 − 0,01278 = 0,00722 моль
2) Определить молярное количество добавляемой HCl:
МЗ = (0,490 моль/л) (0,00630 л) = 0,003087 моль3) HCl будет протонировать Ac¯, в результате чего его количество уменьшится, а количество HAc увеличится.
Ac¯ —> 0,01278 − 0,003087 = 0,009693 моль
HAc —> 0,00722 + 0,003087 = 0,010307 моль4) Используйте уравнение Хендерсона-Хассельбальха для расчета нового pH:
pH = pK a + log [основание/кислота]pH = 4,752 + log [0,009693 / 0,010307]
рН = 4,752 + [-0,027]
рН = 4,725
Проблема № 25a: Мы хотим сделать буфер с pH 5000 и выбираем слабую кислоту (назовем ее HA) с pK и из 4.700. Начиная с 0,100 М ГК и NaA, мы хотим приготовить 100 мл буферного раствора.
Решение:
1) Используйте уравнение Хендерсона-Хассельбаха:
5.000 = 4.700 + log [A¯] / [HA][A¯] / [HA] = 10 0,300
[A¯] / [HA] = 2,00
2) Используйте определение молярности:
M = моль/объеммоля = МВ
моль A¯ = (0,100 моль/л) (L A¯ )
моль ГК = (0,100 моль/л) (л ГА )3) Наше отношение теперь становится:
[(0,100 моль/л) (L A¯ )] / [(0,100 моль/л) (L HA )] = 2,00(L A¯ ) / (L HA ) = 2,00
4) Установите переменные и подставьте в приведенное выше соотношение:
пусть L А¯ = х
, следовательно, L HA = 0,1 − xКомментарий: я использовал 0,1, потому что общий объем = 100 мл или 0,1 л.
х / (0,1 – х) = 2,00
х = 0,2 – 2х
3x = 0,2
х = 0,667 л
Нам требуется 66,7 мл NaA и 33,3 мл HA для приготовления буфера с pH 5.
Задача № 25b: Определите, как вы приготовите 1,00 л этого буфера, начиная с 0,100 М ГК, 0,100 М NaOH и воды, где общая концентрация ГК плюс NaA составляет 0,010 М.
Решение:
pH = pK a + log [основание/кислота]Сумма молей ГК и NaA будет 0,010 моль. Это происходит от общей молярности (0,0100 М), умноженной на конечный объем раствора (1,00 л). Я буду использовать моли в логарифмической части уравнения Хендерсона-Хассельбаха.
5,000 = 4,700 + log [х / (0,01 – х)]
0,300 = логарифм [х / (0,01 – х)]
х / (0,01 – х) = 2
х = 0,02 – 2х
x = 0,00667 моль основания (A¯)
Комментарии:
(a) x представляет количество молей NaA (соли) в 1,00 л раствора
(б) 0,010 – х = 0,00333; это моли ГК в 1,0 л раствора.Как приготовить буфер:
(i) Возьмите 100 мл 0,100 М ГК. Это соответствует 0,0100 моль ГК. (ii) Добавьте 66,7 мл 0,100 М раствора NaOH. Это 0,0067 моль NaOH. NaOH реагирует с ГК с образованием NaA, соли ГК. (iii) Развести водой до 1,00 л. Задача № 26: Рассчитайте объем (в мл) 0,170 М NaOH, который необходимо добавить к 311 мл 0,0485 М HA (обычная слабая кислота), чтобы получить раствор с pH 7,55. pK a HA = 7,18.
Решение:
1) Поскольку моли ГК и соли, образованной из ГК/NaOH (для которой я буду использовать A¯), находятся в одном и том же объеме раствора, мы можем использовать моли в логарифмической части уравнения Хендерсона-Хассельбаха:
7,55 = 7,18 + log (A¯) / (HA − A¯)2) Неизвестными будут моли A¯:
моль ГК —> (0,0485 моль/л) (0,311 л) = 0,0150835 моль3) Я буду использовать неокругленное число.
7,55 = 7,18 + log [(х) / (0,0150835 – х)]0,37 = логарифм (х) / (0,0150835 – х)
4) антилог с обеих сторон
(х) / (0,0150835 – х) = 2,344235) перекрестное умножение
х = 0,035359 – 2,34423х3,34423х = 0,035359
x = 0,0105732 моль A¯ требуется
6) Требуется мл NaOH:
0,0105732 моль / 0,170 моль/л = 0,0621953 л = 62,2 мл (до трех цифр)Задача № 27: Какую массу HCl нужно добавить к 250 мл раствора, содержащего 0,500 М NaC 2 H 3 O 2 и 0,500 M HC 2 H 3 O 2 , чтобы pH = 4,25? K a HC 2 H 3 O 2 1,77 x 10 -5 .
Раствор с родинками:
pH = pK a + log [основание/кислота]4,25 = 4,752 + log [основание/кислота]
−0,502 = log [основание/кислота]
[основание/кислота] = 0,314775 (0,125 – х) / (0,125 + х) = 0,314775 0,039346875 + 0,314775х = 0,125 – х
1,314775x = 0,085653125
х = 0,0651466 моль
(0,0651466 моль) (36,5 г/моль) = 2,38 г
Раствор с молярностью:
(0,5 – х) / (0,5 + х) = 0,3147750,1573875 + 0,314775х = 0,5 – х
1,314775x = 0,3426125
x = 0,2605864 M MV = г/молярная масса
(0,2605864) (0,25) = х/36,5
х = 2,38 г
Задача № 28: Какую массу HCl нужно добавить к 250 мл раствора, содержащего 0,500 М NaC 2 H 3 O 2 и 0,500 M HC 2 H 3 O 2 , чтобы pH = 4,25? K a из HC 2 H 3 O 2 равно 1,77 x 10¯ 5
Решение:
pH = pK a + log [основание/кислота]4,25 = 4,752 + log [основание/кислота]
−0,502 = log [основание/кислота]
[основание / кислота] = 0,314775 (0,125 – x) / (0,125 + x) = 0,314775 HCl превращает ацетат (основание) в кислоту (уксусную кислоту)
0,04001375 + 0,314775х = 0,125 – х
1,314775x = 0,08498625
х = 0,0646394 моль
(0,0646394 моль) (36,4609 г/моль) = 2,36 г
Задача № 29: Сколько мл 0,75 М HCl нужно добавить к 120 мл 0,90 М формиата натрия, чтобы получить буфер с рН = 4,00? pK a муравьиной кислоты = 3,75
Решение:
1) Я буду использовать уравнение Хендерсона-Хассельбаха для решения задачи, но количества кислоты и основания будут выражены в молях, а не в молях.
pH = pK a + log [основание/кислота]2) Определите родинки формиата:
(0,90 моль/л) (0,12 л) = 0,108 моль3) HCl протонирует часть формиата, образуя муравьиную кислоту. Таким образом, количество формиата уменьшится с 0,108 моль, а количество муравьиной кислоты увеличится с нуля.
4,00 = 3,75 + log (0,108 – х) / хlog (0,108 – х) / х = 0,25
(0,108 – х) / х = 1,77828
1,77828х = 0,108 – х
2,77828х = 0,108
х = 0,038873 моль
4) Поскольку прореагировавшая HCl и образовавшаяся муравьиная кислота находятся в молярном соотношении 1:1, мы можем определить требуемый объем HCl:
0,038873 моль / 0,75 моль/л = 0,05183 л = 51,8 мл5) В качестве проверки подставим моли обратно в уравнение H-H следующим образом:pH = 3,75 + log (0,069127/0,038873)pH = 3,75 + 0,25 = 4,00
Можно также использовать молярности (делив количество молей на общий объем 0,1718 л).
Задача №30a: Вам необходимо приготовить буферный раствор с pH 4,178 из 25,0 мл 0,282 М раствора натриевой соли слабой кислоты, NaA, где pK a слабой кислоты HA составляет 4,270. Какой объем 0,329 М HCl вам потребуется добавить?
Решение:
1) Уравнение Хендерсона-Хассельбальха выглядит следующим образом:
[базовый] pH = pK a + log ––––– [кислота] 2) Мы уже знаем два значения:
[базовый] 4,178 = 4,270 + log ––––– [кислота] 3) Анион слабой кислоты (А¯) является основанием, а НА будет кислотой. Мы знаем, что добавление некоторого количества HCl превратит часть A¯ в HA.
Определим, сколько A¯ у нас имеется:
(0,282 моль/л) (0,025 л) = 0,00705 моль4) Это количество A¯ уменьшится на некую неизвестную величину, когда оно прореагирует с HCl. Но вот ключ: сумма HA вырастет точно на ту же величину. Это позволяет мне заполнить уравнение HH:
0,00705 − х 4,178 = 4,270 + log –––––––––– х 0,00705 − x —> это количество оставшегося A¯ (после того, как весь HCl израсходован)
x —> это количество произведенной HA5) Все это работает благодаря молярному соотношению 1:1 между израсходованным A¯ и произведенным HA. Теперь немного алгебры:
0,00705 − х журнал –––––––––– = −0,092 х
0,00705 – х –––––––––– = 0,809096 х 0,00705 – х = 0,809096х
1,809096х = 0,00705
х = 0,00389697 моль
6) Из-за молярного соотношения 1:1 в химической реакции нам также нужны моли HCl.
По объему HCl:
0,00389697 моль / 0,329 моль/л = 0,0118449 л = 11,8449 млНа три знака инжира ответ равен 11,8 мл
Задача №30b: Вам необходимо приготовить ацетатный буфер с рН 5,83 из 0,642 М раствора уксусной кислоты и 2,31 М раствора КОН. Если у вас есть 975 мл раствора уксусной кислоты, сколько миллилитров раствора КОН вам нужно добавить, чтобы получить буфер с рН 5,830? pK a уксусной кислоты составляет 4,752.
Решение:
1) Мы будем использовать уравнение Гендерсона-Хассельбаха:
pH = pK a + log [основание/кислота]2) Вот H-H, настроенный с тем, что мы знаем:
5,830 = 4,752 + log [основание/кислота]3) Количество основания и кислоты будет выражено в молях. Основанием, кстати, является ацетат-анион, а не КОН.
Мы не знаем, сколько ацетата требуется, поэтому назовем его x.Количество уксусной кислоты:
0,62595 − х0,62595 моль получается из этого:
(0,642 моль/л) (0,975 л) = 0,62595 мольМинус x связан с тем, что часть уксусной кислоты будет преобразована в ацетат в молярном соотношении 1:1.
4) Теперь мы готовы к выполнению H-H:
5,830 = 4,752 + log [х / (0,62595 – х)]5) Теперь немного алгебры:
log [х / (0,62595 – х)] = 1,078х / (0,62595 – х) = 11,9674
х = 7,490994 – 11,9674 х
12,9674x = 7,490994
x = требуется 0,57768 моль ацетата
6) Из-за молярного соотношения 1:1 между израсходованным OH¯ и полученным ацетатом количество молей ацетата равно количеству требуемых молей KOH.
0,57768 моль разделить на 2,31 моль/л = 0,250078 л0,250078 L = 250 мл (до трех знаков фиг.)
Бонусная задача: pK a для фенофталеина составляет 9,3 при комнатной температуре.
(а) Рассчитайте отношение его анионной формы к кислотной форме при рН 8,2 и при рН 10.
(b) Используя эти значения, объясните изменение цвета в этом диапазоне pH.Решение части (а):
1) При pH = 8,2:
8,2 = 9,3 + log (основная форма / кислотная форма)log (основная форма / кислотная форма) = -1,1
отношение основной формы к кислотной форме = 0,0794 к 1 (назовем это 8 к 100)
2) При pH = 10.
:
10 = 9,3 + log (основная форма / кислотная форма)log (основная форма/кислотная форма) = 0,7
отношение основной формы к кислотной форме = 5,01 к 1 (назовем это 500 к 100)
Решение части (b):
1) Ключевой факт:
это анионная (или основная) форма, окрашенная в розовый цвет. Кислотная форма бесцветна.2) При pH = 8,3:
розовая форма находится в меньшинстве при этом рН. На каждые 100 кислых (бесцветных) форм приходится только 8 основных (розовых) форм.3) При pH = 10.:
бесцветная форма в меньшинстве. На каждые 100 присутствующих кислых (бесцветных) форм теперь приходится 500 основных (розовых) форм.4) Это означает:
От pH = 8,3 до pH = 10 наблюдалось увеличение количества розовых форм на 6250% (от 8:100 до 500:100).Хотя при pH 8,3 может наблюдаться слегка розовый цвет (на белом фоне), популяция розовых форм значительно увеличилась при pH = 10, до такой степени, что теперь розовый цвет легко виден даже без посторонней помощи.
белого фона.
Пятнадцать примеров буфера Проблемы с буфером 1–10 Проблемы с буфером 11–20 Проблемы с буфером 31–40 Введение. к уравнению Хендерсона-Хассельбальха Вернуться в меню «Кислотно-основное»
Оптимальное использование буферных объемов для измерения концентрации атмосферных газов в многоточечных системах
Научная статья
|21 сентября 2016 г.
Исследовательская статья | | 21 сентября 2016 г.Алессандро Ческатти , Барбара Марколла, Игнасио Годед и Карстен Грунинг
Резюме. Точные многоточечные системы мониторинга необходимы для проведения атмосферных измерений концентраций парниковых газов как для расчета приземных потоков с помощью инверсионных моделей переноса, так и для оценки нетурбулентных компонентов уравнения баланса массы (т. е. потоков адвекции и накопления) при сайты вихревой ковариации. Когда один анализатор используется для мониторинга нескольких точек отбора проб, развертывание буферных объемов (BV) вдоль линий отбора проб может уменьшить неопределенность из-за дискретной временной выборки сигнала. Чтобы оптимизировать использование буферных объемов, мы исследовали различные настройки, моделируя их влияние на временные ряды высокочастотного CO 9 .Концентрация 0027 2 собрана на трех сайтах Fluxnet. Кроме того, нами была предложена новая схема расчета получасовых взвешенных средних арифметических по дискретным точечным отсчетам с учетом вероятностной доли сигнала, генерируемого в период усреднения. Результаты показывают, что использование BV с новой схемой усреднения снижает среднюю абсолютную ошибку (MAE) до 80 % по сравнению с установкой без BV и до 60 % по сравнению со случаем с BV и стандартным невзвешенным значением. схема усреднения. МАЭ CO 2 измерения концентрации зависят от изменчивости поля концентрации и от размера BV, которые поэтому должны быть тщательно рассчитаны.
е. потоков адвекции и накопления) при сайты вихревой ковариации. Когда один анализатор используется для мониторинга нескольких точек отбора проб, развертывание буферных объемов (BV) вдоль линий отбора проб может уменьшить неопределенность из-за дискретной временной выборки сигнала. Чтобы оптимизировать использование буферных объемов, мы исследовали различные настройки, моделируя их влияние на временные ряды высокочастотного CO 9 .Концентрация 0027 2 собрана на трех сайтах Fluxnet. Кроме того, нами была предложена новая схема расчета получасовых взвешенных средних арифметических по дискретным точечным отсчетам с учетом вероятностной доли сигнала, генерируемого в период усреднения. Результаты показывают, что использование BV с новой схемой усреднения снижает среднюю абсолютную ошибку (MAE) до 80 % по сравнению с установкой без BV и до 60 % по сравнению со случаем с BV и стандартным невзвешенным значением. схема усреднения. МАЭ CO 2 измерения концентрации зависят от изменчивости поля концентрации и от размера BV, которые поэтому должны быть тщательно рассчитаны. Оптимальный размер объема зависит от двух основных особенностей настройки прибора: количества точек измерения и времени, необходимого для отбора проб в одной точке (т. е. продувки линии плюс время отбора проб). На всех участках наблюдалась линейная и последовательная зависимость между частотой выборки, которая суммирует две упомянутые выше особенности, и частотой обновления, связанной с объемом. В конечном счете, это эмпирическое соотношение может быть применено для оценки оптимального размера объема в соответствии с техническими характеристиками системы выборки.
Оптимальный размер объема зависит от двух основных особенностей настройки прибора: количества точек измерения и времени, необходимого для отбора проб в одной точке (т. е. продувки линии плюс время отбора проб). На всех участках наблюдалась линейная и последовательная зависимость между частотой выборки, которая суммирует две упомянутые выше особенности, и частотой обновления, связанной с объемом. В конечном счете, это эмпирическое соотношение может быть применено для оценки оптимального размера объема в соответствии с техническими характеристиками системы выборки.
Получено: 18 января 2016 г. – Начало обсуждения: 15 марта 2016 г. – Пересмотрено: 09 августа 2016 г. – Принято: 26 августа 2016 г. – Опубликовано: 21 сентября 2016 г. системы мониторинга необходимы для измерения концентрации атмосферных газов на высоких башнях и в местах ковариации вихрей. Использование буферных объемов может уменьшить неопределенность из-за дискретной временной выборки. Мы предлагаем схему обработки, учитывающую долю сигнала, накопленного за период усреднения, и уменьшающую ошибку до 80 % по сравнению со стандартной установкой.

 Это НЕ буфер, и pH будет рассчитываться с использованием концепции сильного основания.
Это НЕ буфер, и pH будет рассчитываться с использованием концепции сильного основания.
 Количество ацетата уменьшается, а количество уксусной кислоты увеличивается. Обратите внимание, что все стехиометрии реакции равны 1:1.
Количество ацетата уменьшается, а количество уксусной кислоты увеличивается. Обратите внимание, что все стехиометрии реакции равны 1:1.


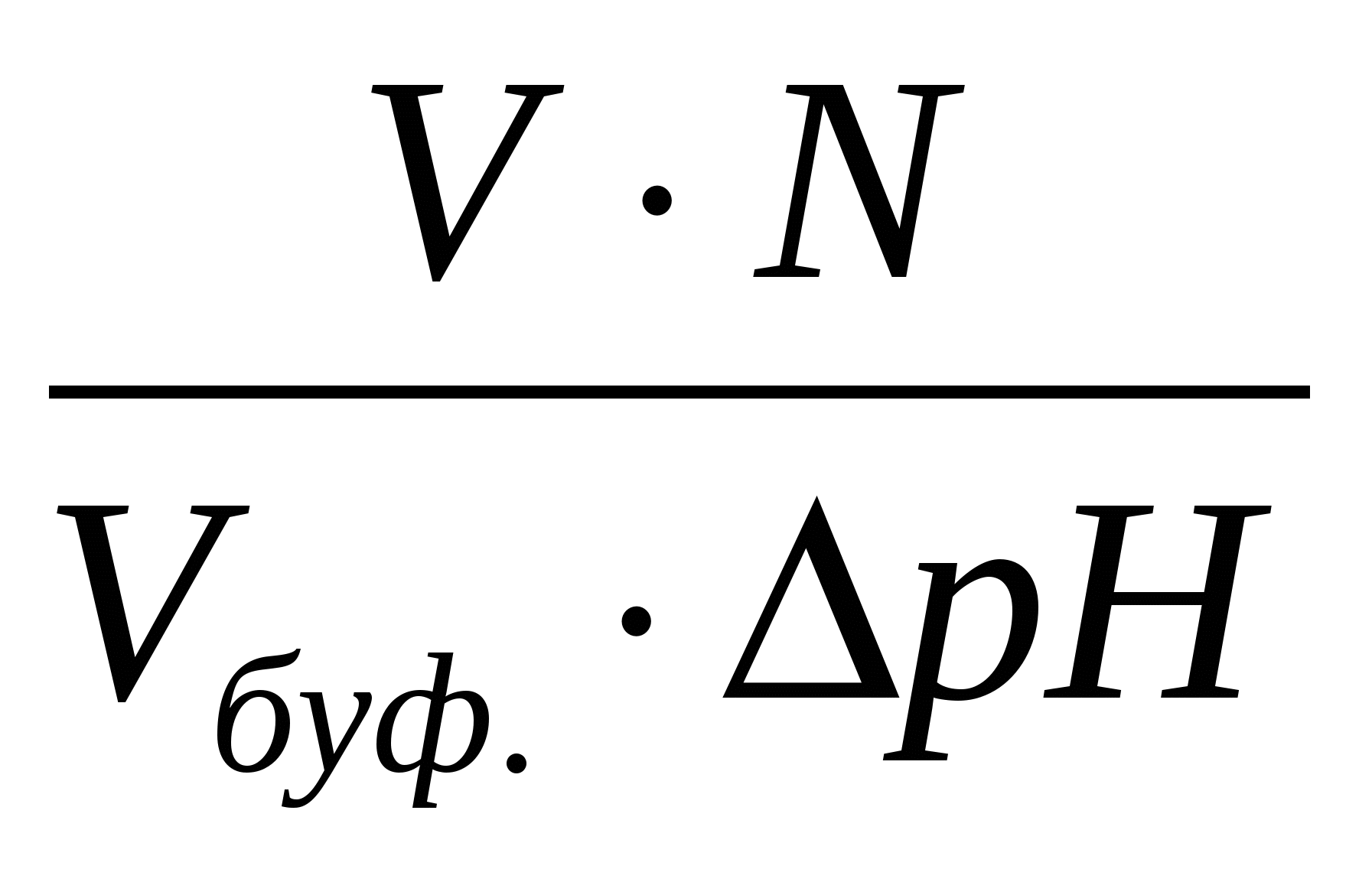


 Определим, сколько A¯ у нас имеется:
Определим, сколько A¯ у нас имеется: По объему HCl:
По объему HCl:
 :
: белого фона.
белого фона.