Буферная емкость
Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: Скислоты/Ссолиили Соснования/Ссоли.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно
буферное действие раствора характеризуется
с помощью буферной емкости (В).
Буферной емкостью по кислотеявляется то количество химического эквивалента сильной кислоты, которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
где n(1/z HA) – число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 – водородный показатель системы до добавления сильной кислоты;рН2 – водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм 3) формула для подсчета буферной емкости будет иметь следующий вид:
где
С(1/z НА) – молярная
концентрация химического эквивалента
сильной кислоты в добавляемом растворе; V(НА) – объем (л)
добавленного раствора сильной кислоты; V(буферной
системы) – объем буферного
раствора, к которому добавляют раствор
кислоты.
Соответственно, буферной емкостью по основаниюявляется то количество химического эквивалента сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы вызвать увеличение ее рН на единицу:
где n(1/z В) – число молей химического эквивалента основания, которое добавили к 1 литру буферного раствора; рН
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
где
С(1/z В) – молярная
концентрация химического эквивалента
основания в добавляемом растворе; V(В)
– объем (л) добавленного раствора
сильного основания; V(буферной
системы) – объем буферного
раствора (л), к которому добавляют раствор
сильного основания.
Величина буферной емкости зависит от концентраций компонентов буферной системы и от их соотношения.
Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление небольших количеств сильной кислоты или щелочи не вызовет существенного изменения концентраций его компонентов, а значит и их соотношения.
Из буферных растворов с одинаковым суммарным содержанием химического количества их компонентов наибольшей емкостью будут обладать те, которые составлены из равного числа молей слабой кислоты и её соли или слабого основания и его соли (рис. 35). В таких растворах молярные концентрации компонентов будут одинаковые, а значит соотношение Скислоты/Ссоли= 1 и Соснования/ Ссоли.= 1.
Рис. 35. Изменение буферной емкости (1) и изменение рН кислотной буферной системы при добавлении к ней определенного количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы
будут иметь примерно одинаковые значения
буферной емкости как по кислоте, так и
по основанию.
Если же соотношение концентраций компонентов буферной системы не равно 1, то значения ее буферной емкости по основанию и кислоте будут отличаться друг от друга (причем тем существеннее, чем в большей степени соотношение Скислоты/Ссолии Соснования/Ссолиотклоняется от единицы).
Например, если в кислотной буферной системе солевой компоненты содержится больше, чем слабой кислоты, то ее буферная емкость по кислоте будет выше, чем по основанию, т.е. Вк.> Во.
Соответственно, буферная емкость по кислоте для основной буферной системы будет больше, чем по основанию, в том случае, если содержание солевой компоненты в этом случае будет меньше, чем слабого основания.
Таким образом, можно сделать вывод, что в данных случаях буферная емкость выше по тому веществу, которое реагирует с избыточным компонентом буферного раствора.
Если буферная
система не обладает достаточной буферной
емкостью, ее можно повысить, увеличив
концентрацию обоих компонентов в
необходимое количество раз.
34. Буферная емкость. Влияние добавления или щелочи на pH среды буферных систем. Буферная емкость по кислоте(Ва) и по щелочи(Вв). Факторы, определяющие буферную емкость.
Буферная емкость – равна количеству вещества сильной кислоты или сильного основания, которое следует добавить к одному л буферного раствора, что бы изменить значение pH
Буферная ёмкость по кислоте: Буферная емкость по основанию:
Ва==Вв==
n(1/z к-ты) и n(1/zосн) – количество эквивалента кислоты и основания (моль)
С(1/z к-ты) и С(1/z осн) – молярная концентрация эквивалента кислоты и основания
∆ pH = pH0 – pH
pH0 и pH – значения pH буферного раствора до и после добавления кислоты или щелочи
Буферная емкость зависит от факторов:
Чем больше количество компонентов кислотно-основной пары (основание/сопряженная к-та), тем выше буферная емкость раствора
=1 maxB
Буферная емкость зависит от pH буферного раствора
35.
 Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей.
Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей.Бикарбонатная буферная система: NaHCO3/ h3CO3:
Наиболее важная буферная система крови, на её долю в крови приходится больше 50% буферного действия. Кислоты, образованные в организме в результате метаболизма попадают в кровь, где связываются с бикарбонатной буферной системой: NaHCO3 + HCl⤑ NaCl + h3CO3
Угольная кислота переносится кровью в легкие, что обеспечивает выделение CO2 в воздух: h3CO3⤑ CO2 + H2O таким путем организм освобождается от избытка кислоты, накапливаемой соли и H 2O удаляются с мочой и потом. Убыль бикарбоната пополняется в процессе тканевого дыхания.
Если в кровь попадает щелочь: h3CO3 + NaOH NaHCO3 + H2O
Расчет pH бикарбонатной буферной системы происходит по уравнению Гендерсона-Гессельбаха:
pH= pKa (h3CO3)+lg pKa (h3CO3)=6,36
Фосфатная буферная система: Na2HPO4/NaH2PO4
Имеет
наибольшее значение в биологических
жидкостях(моче, крови, соке пищеварительных
желез) и главным образом сосредоточено
в почках.
Расчет pH= pK (H2PO4–)+lg
Имеет более высокую емкость по кислоте, чем по щелочи, поэтому она эффективно нейтрализует кислые метаболиты, поступающие в кровь.
Т.к. буферная емкость по кислоте и по щелочи данной буферной системы мало отличается друг от друга поэтому фосфатная система участвует в нейтрализации основных продуктов
Щелочь, попадая в почки, то происходит нейтрализация кислоты щелочью: NaH2PO4 + NaOH Na2HPO4 + H2O
Белковая буферная система:
Значительную долю буферной емкости крови обеспечивают белковые системы(гемоглобин, оксигемоглобин, белки плазмы)
Благодаря белкам клетки и ткани организма проявляют значительные буферные действия.
Молекула белков содержит остатки аминокислот : NH2 – CH(R) – COOH
Аминокислоты – амфотерные электролиты. COOH COO–
Белковая буферная система состоит из протеинов: Pt ↔ Pt
: NH2
NH3 сопряженное основание(внутр. соль)
соль)Изоэлектрическая точка – значение pH при котором аминокислота или белки находятся в виде внутренней соли и количество COO– и NH3 равны.
COOH COOH
Pt + HCl ⤑ Pt
NH3 NH3Cl солянокислый протеин
При добавлении кислоты ионы Н+ связываются соленой формой. Количество незначительной кислоты повышается, а солевая форма белка понижается, поэтому pH остается постоянным.
При добавлении щелочи к данному буферному раствору:
COOH COONa
Pt + NaOH ⤑ Pt
NH3 NH3OH протеинат натрия
Количество солевой формы белка повышается, а внутренние соли понижаются. pH практически не меняется
Гемоглобиновая буферная система:
Сосредоточена в эритроцитах.
Состоит
из четырех компонентов, поэтому обладает
высокой буферной емкостью.
ННв↔ НВ– + Н+ ННВ – гемоглобиновая кислота
ННвО2 ↔Н+ + НВО2– ННвО2 – оксигемоглобиновая кислота
Гемоглобиновая буферная система в организме работает в сочетании с бикарбонатной. В легких гемоглобин взаимодействует с О2 воздуха образуется оксигемоглобин: ННв + О2 ⤑ ННвО2
Оксигемоглобин как более сильная кислота взаимодействует с HCO3– с образованием более слабой h3CO3 ⤑ удаляется легкими
ННв + О2 + HCO3– = НВО2– + H2O + СО2 процесс, протекающий в легочных капиллярах
НВО2– + H2CO3 = О2 + ННв + HCO3– процесс, протекающий в тканевых капиллярах
7.2: Практические аспекты буферов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 164772
Развитие навыков
- Понимание факторов, влияющих на диапазон и емкость буфера
- Рассчитать количества кислоты и основания, необходимые для приготовления буфера с заданным рН
Буферы характеризуются диапазоном рН, в котором они могут поддерживать более или менее постоянное значение рН, и их буферной емкостью, т. е. количеством сильной кислоты или основания, которое может быть абсорбировано до того, как рН значительно изменится. Хотя полезный диапазон pH буфера сильно зависит от химических свойств слабой кислоты и слабого основания, используемых для приготовления буфера (т. е. от \(K\)), его буферная емкость зависит исключительно от концентрации соединений в буферный раствор.
е. количеством сильной кислоты или основания, которое может быть абсорбировано до того, как рН значительно изменится. Хотя полезный диапазон pH буфера сильно зависит от химических свойств слабой кислоты и слабого основания, используемых для приготовления буфера (т. е. от \(K\)), его буферная емкость зависит исключительно от концентрации соединений в буферный раствор.
Буферная емкость
Буферные растворы не обладают неограниченной емкостью для поддержания относительно постоянного уровня pH (Рисунок \(\PageIndex{1}\)). Если мы добавим в буфер такое количество основания, что слабая кислота будет исчерпана, буферное действие по отношению к основанию будет невозможно. С другой стороны, если мы добавим избыток кислоты, слабое основание будет исчерпано, и буферное действие по отношению к любой дополнительной кислоте будет невозможно. На самом деле нам даже не нужно исчерпать всю кислоту или основание в буфере, чтобы переполнить его; его буферное действие будет быстро уменьшаться по мере того, как данный компонент приближается к истощению.
Буферная емкость — это количество кислоты или основания, которое можно добавить к заданному объему буферного раствора до того, как рН значительно изменится, обычно на одну единицу. Буферная емкость зависит от количества слабой кислоты и сопряженного с ней основания, находящихся в буферной смеси.
Чем более концентрирован буферный раствор, тем больше его буферная емкость.
Как показано на рисунке \(\PageIndex{2}\), при добавлении \(NaOH\) к растворам, содержащим разные концентрации буфера уксусной кислоты/ацетата натрия, наблюдаемое изменение рН буфера обратно пропорционально пропорциональна концентрации буфера. Если буферная емкость в 10 раз больше, то буферный раствор может поглотить в 10 раз больше сильной кислоты или основания, прежде чем претерпит значительное изменение рН.
Если буферная емкость в 10 раз больше, то буферный раствор может поглотить в 10 раз больше сильной кислоты или основания, прежде чем претерпит значительное изменение рН.
Буфер поддерживает относительно постоянное значение pH при добавлении в раствор кислоты или основания. Добавление даже крошечных объемов 0,10 М \(NaOH\) к 100,0 мл дистиллированной воды приводит к очень большому изменению рН. По мере увеличения концентрации смеси буфера ацетата натрия/уксусной кислоты в соотношении 50:50 в растворе с 0,010 М до 1,00 М изменение рН, вызываемое добавлением того же объема раствора \(NaOH\), неуклонно уменьшается. . При концентрации буфера не менее 0,500 М добавление даже 25 мл раствора \(NaOH\) приводит лишь к относительно небольшому изменению рН.
Диапазон буфера
Диапазон буфера — это диапазон значений pH, при котором буфер наиболее эффективен (т. е. имеет наибольшую буферную емкость для своей концентрации).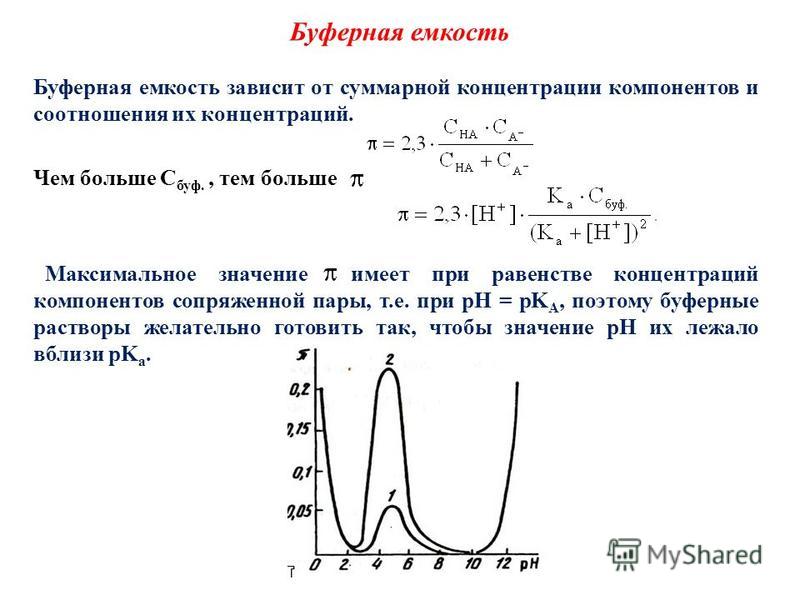 Хорошая буферная смесь должна иметь примерно равные концентрации обоих компонентов. Как правило, буферный раствор теряет свою полезность, когда один компонент буферной пары составляет менее 10% от другого. На рисунке \(\PageIndex{3}\) показан буфер уксусной кислоты и ацетат-иона при добавлении основания. Начальное значение pH равно 4,74 (pK_a\ уксусной кислоты). Изменение на 1 единицу pH происходит, когда концентрация уксусной кислоты снижается до 11% от концентрации ионов ацетата. После этой точки рН начинает меняться быстрее при добавлении основания, поскольку буфер переполняется.
Хорошая буферная смесь должна иметь примерно равные концентрации обоих компонентов. Как правило, буферный раствор теряет свою полезность, когда один компонент буферной пары составляет менее 10% от другого. На рисунке \(\PageIndex{3}\) показан буфер уксусной кислоты и ацетат-иона при добавлении основания. Начальное значение pH равно 4,74 (pK_a\ уксусной кислоты). Изменение на 1 единицу pH происходит, когда концентрация уксусной кислоты снижается до 11% от концентрации ионов ацетата. После этой точки рН начинает меняться быстрее при добавлении основания, поскольку буфер переполняется.
Рисунок \(\PageIndex{3}\): График, иллюстрирующий буферное действие, показывает изменение рН по мере добавления увеличивающегося количества 0,10 М раствора NaOH к 100 мл буферного раствора, в котором изначально [CH 3 CO 2 H] = 0,10 М и \(\ce{[Ch4CO2- ]}=0,10\:M\)
Наиболее эффективные буферы содержат равные концентрации кислоты и сопряженного с ней основания.
Рисунок \(\PageIndex{4}\): Кривая распределения, показывающая долю молекул уксусной кислоты и ионов ацетата в зависимости от pH в растворе уксусной кислоты. Диапазон pH, в котором система уксусная кислота/ацетат натрия является эффективным буфером (более темная заштрихованная область), соответствует области, в которой присутствуют заметные концентрации обоих веществ (pH 3,76–5,76, что соответствует \(pH = pK_a \pm 1\)).-\) к \(CH_3CO_2H\) с 1:1 снижает буферную емкость раствора.
Напомним, что в соответствии с соотношением Хендерсона-Хассельбаха pH = \(pK_a\), когда буфер содержит равные концентрации конъюгированной кислоты и основания. Таким образом, эффективный диапазон буфера составляет примерно \(pK_a\) плюс или минус одна единица pH. Это соответствует концентрации двух компонентов десять к одному в любом случае, как показано выше.
Диапазон буфера приблизительно равен \(pH = pK_a \pm 1\)
Подготовка буферов
Во многих случаях химикам приходится готовить буферные растворы для поддержания желаемого уровня pH.
Существует множество различных буферных систем на выбор, в зависимости от требуемых характеристик и pH раствора. При приготовлении буфера в лаборатории можно использовать следующие шаги:
- Выберите подходящую буферную систему. Поскольку буферная емкость самая высокая при pH = \(pK_a\), идеальный буфер будет иметь \(pK_a\), близкий к желаемому pH. В общем, слабые кислоты и их соли лучше подходят в качестве буферов при рН менее 7; слабые основания и их соли лучше подходят в качестве буферов при рН выше 7.
- Используйте общую концентрацию буфера и желаемый рН для расчета количеств кислоты и основания, необходимых для создания буфера. Уравнение Хендерсона-Хассельбаха можно использовать для определения необходимого соотношения [основания]/[кислоты].
- Смешайте компоненты. Слабая кислота может быть добавлена непосредственно к соли сопряженного основания; в качестве альтернативы, к слабой кислоте можно добавить достаточно сильное основание, чтобы частично превратить ее в сопряженное основание (или можно добавить сильную кислоту к слабому основанию, чтобы частично нейтрализовать его).
- Отрегулируйте pH по желанию. На практике экспериментальная ошибка и другие факторы часто приводят к тому, что буферы не совсем соответствуют расчетному pH, поэтому химик может добавить небольшое количество сильной кислоты или сильного основания для точной настройки pH, контролируя раствор с помощью pH-метра.
Пример \(\PageIndex{1}\) иллюстрирует метод расчета количества реагентов, необходимых для создания буфера с заданным значением pH.
Пример \(\PageIndex{1}\)
\(pK_a\) муравьиной кислоты составляет 3,75. Сколько граммов муравьиной кислоты (\(HCO_2H\)) и формиата натрия (\(HCO_2Na\)) необходимо смешать, чтобы приготовить 100,0 мл буфера с общей концентрацией 0,100 М и рН 3,90?
Дано : \(pK_a\) муравьиной кислоты, объем буфера, общая концентрация буфера, желаемый pH
Запрашиваемый : граммы \(HCO_2H\) и \(HCO_2Na\)
Стратегия : Используйте приближение Хендерсона-Хассельбаха, чтобы определить необходимое соотношение [основание]/[кислота], затем используйте общую концентрацию и объем для расчета количества молей каждого необходимого компонента, конвертируйте моли в граммы
Решение:
Согласно приближению Хендерсона-Хассельбальха, 9{0,15} = 1,16\]
Это соотношение означает, что буфер должен содержать в 1,16 раза больше молей \(HCO_2Na\), чем \(HCO_2H\), чтобы получить pH 3,90.
Это имеет смысл, потому что желаемый pH выше, чем \(pK_a\), поэтому необходимо больше сопряженного основания, чем кислоты.
Мы знаем, что нам нужно создать 100,0 мл буфера с общей концентрацией 0,100 М:
\(\mathrm{100,0 мл×\dfrac{1 л}{1000 мл}×\dfrac{0,100 моль}{1 L}= 0,0100\:моль}\)
Таким образом, нам нужно всего 0,0100 моль обоих компонентов буфера. Мы можем составить следующие два уравнения:
\(\mathrm{моль(HCO_2Na) + моль(HCO_2H) = 0,0100\:моль}\)
\(\mathrm{моль(HCO_2Na)/моль(HCO_2H) = 1,16}\) или \(\mathrm {моль(HCO_2Na) = 1,16×моль(HCO_2H)}\)
С двумя уравнениями и двумя неизвестными подставляем одно выражение в другое, чтобы найти оба компонента:
\(\mathrm{1,16×моль(HCO_2H) + моль(HCO_2H) = 2,16×моль(HCO_2H) = 0,0100\:моль}\)
\(\mathrm{моль(HCO_2H) = 0,00463\:моль\:HCO_2H}\)
\(\mathrm{моль (HCO_2Na) = 1,16×0,00463\:моль = 0,00537\:моль\:HCO_2Na}\)
Наконец, вычисляем граммы, используя молярную массу каждого компонента: \:г\:HCO_2H}\)
\(\mathrm{0,00537\:моль\:HCO_2Na×\dfrac{68,01\:г}{1\:моль\:HCO_2Na}=0,365\:г\:HCO_2Na} \)
Упражнение \(\PageIndex{1}\)
Биохимику требуется 250 мл 0,15 М ацетатно-уксусного буфера с рН 5,00.
Сколько граммов \(CH_3CO_2H\) и \(CH_3CO_2Na\) она должна добавить, чтобы создать буферную смесь (\(pK_a\) уксусной кислоты 4,74)?
- Ответить
0,98 г \(CH_3CO_2H\) и 1,74 г \(CH_3CO_2Na\)
Резюме
Буферы характеризуются диапазоном pH и буферной емкостью. Полезный диапазон pH буфера зависит от химических свойств сопряженной пары слабых кислот и оснований, используемой для приготовления буфера, и обычно равен \(pK_a \pm 1\). Буферная емкость зависит от концентрации частиц в растворе; чем более концентрирована буферная смесь, тем выше буферная емкость. Буфер имеет наибольшую емкость при равных концентрациях слабой кислоты и сопряженного основания, когда \(pH = pK_a\).
7.2: Практические аспекты буферов распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- буфер
- емкость буфера
- приближение Хендерсона-Хассельбаха
- источник-хим-25184
- зрительский ион
Факторы, влияющие на емкость буфера — Solution Parmacy
Суджей Мистри
Буферная емкость:Содержание
Буферная емкость является количественной мерой эффективности буфера в сопротивлении изменениям рН. Его можно определить как «максимальное количество либо сильной кислоты, либо сильного основания, которое можно добавить до того, как произойдет значительное изменение pH.
Проще говоря, буферная система может противостоять изменениям рН. На это указывает индекс буфера термина (β).
Обычно буферная емкость выражается как количество сильной кислоты или основания в грамм-эквивалентах, которое необходимо добавить к одному литру раствора, чтобы изменить его рН на одну единицу. Математически буферная емкость выражается следующим образом:
уравнение (1)где ∆B — это грамм-эквивалент сильной кислоты или основания, добавляемого для изменения pH 1 литра буферного раствора, а ∆pH — это изменение pH, вызванное добавлением сильной кислоты или основания. . Практически можно измерить меньшие изменения pH. Буферная емкость количественно выражается как отношение добавленной кислоты или основания к произведенному изменению рН.
Он должен быть достаточно большим, чтобы поддерживать рН продукта в течение достаточно длительного срока годности. Изменения pH продукта могут быть связаны с взаимодействием компонентов раствора друг с другом или с типом упаковки продукта, например, стекло, пластик, резиновые пробки и т.
д. С другой стороны, буферная емкость офтальмологических и парентеральных препаратов должна быть достаточно низким, чтобы можно было быстро привести продукт к физиологическому pH при введении. Необходимо учитывать рН, химическую природу и объем вводимого раствора. Буферная емкость в диапазоне от 0,01 до 0,1 обычно достаточна для большинства фармацевтических растворов.
Емкость буфера всегда положительна. Он выражается как нормальная концентрация (эквиваленты на литр) сильной кислоты или основания, которая изменяет рН на 1,0. Чем больше буферная емкость, тем меньше изменение рН при добавлении данного количества сильной кислоты или основания. Индекс буфера обычно определяется экспериментально путем титрования. Например, при добавлении 0,03 моля гидроксида натрия к 0,1 М ацетатной буферной системе рН увеличивается с 4,76 до 5,03 с изменением рН на 0,27 ед., табл.1. Следовательно, подставляя значения в уравнение (1), имеем;
Таблица.1: Буферная емкость растворов (при одинаковых концентрациях уксусной кислоты и ацетата натрия)Важно помнить, что буферная емкость является самой высокой при добавлении наименьшего количества молей NaOH.
Его повышают за счет увеличения концентрации компонентов буферной системы. Удвоение общей молярной концентрации буферной системы удвоит емкость буфера при данном рН. Буфер также можно увеличить, используя эквимолярные концентрации кислоты (ГК) и сопряженного с ней основания (А – ). Буфер имеет наибольшую емкость, когда отношение [соль]/[кислота] равно 1, т.е. [ГК] = [А – ]. Следовательно, уравнение буфера (1) может быть записано как
pH = pKa …уравнение (2)
Факторы, влияющие на буферную емкость 1. Отношение [A – ]/[HA] 9 0282Буферная емкость существенно зависит от отношения соли к кислоте или основанию. Фактические концентрации А – и ГК влияют на эффективность буфера. Чем больше А – и молекул ГК, тем меньше влияние добавления сильной кислоты или основания на рН системы. Например, рассмотрим добавление сильной кислоты, такой как HCl. Первоначально HCl отдает свой протон слабому основанию (A – ) в результате реакции
A – + HCl → HA + Cl –
Это изменяет pH за счет снижения отношения [A – ]/[HA], но если присутствует много A – , изменение pH будет небольшим.
Но если мы продолжим добавлять HCl, слабое основание A — будут удалены. Как только A – истощается, любое добавление HCl будет отдавать свой протон воде, как показано в приведенной ниже реакции.
HCl + H 2 O → H 3 O + + Cl –
Это резкое увеличение [H + ] приводит к падению pH, называемому «нарушение буферный раствор». Количество кислоты, которое буфер может поглотить до того, как он разрушится, называется «буферной емкостью для добавления сильной кислоты». Решение с более слабым основанием [A – ], имеет более высокую буферную емкость для добавления сильной кислоты. Точно так же буфер может разрушиться, когда количество добавленного сильного основания настолько велико, что оно поглощает всю слабую кислоту в результате реакции с более слабой кислотой [HA] имеет более высокую буферную емкость для добавления сильного основания. Буферная емкость оптимальна при соотношении 1:1; то есть когда pH = pKa.
2. Общая концентрация буфера:Объем буфера зависит от общей концентрации буфера. Например, для истощения 0,5 М буфера потребуется больше кислоты или основания, чем 0,05 М буфера. Связь между буферной емкостью и концентрациями буфера определяется уравнением Ван-Слайка:
уравнение (3)где C — общая концентрация буфера (т. е. сумма молярных концентраций кислоты и соли). Буферный раствор, содержащий слабую кислоту и ее соль, имеет максимальную буферную емкость
(β max ), когда pH = pKa, т.е. [H 3 O + ] = Ka. Следовательно, заменив [H 3 O + ] вместо Ka в уравнении (3), мы получим
уравнение (4) 3. Температура:В продаже имеются буферы с широким диапазоном значений pH, и они поставляются как в предварительно смешанной жидкой форме, так и в виде удобного сухого порошка, капсул или таблеток (для добавления в дистиллированную воду). Эти растворы содержат кислоты и основания, равновесие которых зависит от температуры.

 -\) к \(CH_3CO_2H\) с 1:1 снижает буферную емкость раствора.
-\) к \(CH_3CO_2H\) с 1:1 снижает буферную емкость раствора. Существует множество различных буферных систем на выбор, в зависимости от требуемых характеристик и pH раствора. При приготовлении буфера в лаборатории можно использовать следующие шаги:
Существует множество различных буферных систем на выбор, в зависимости от требуемых характеристик и pH раствора. При приготовлении буфера в лаборатории можно использовать следующие шаги:
 Это имеет смысл, потому что желаемый pH выше, чем \(pK_a\), поэтому необходимо больше сопряженного основания, чем кислоты.
Это имеет смысл, потому что желаемый pH выше, чем \(pK_a\), поэтому необходимо больше сопряженного основания, чем кислоты. Сколько граммов \(CH_3CO_2H\) и \(CH_3CO_2Na\) она должна добавить, чтобы создать буферную смесь (\(pK_a\) уксусной кислоты 4,74)?
Сколько граммов \(CH_3CO_2H\) и \(CH_3CO_2Na\) она должна добавить, чтобы создать буферную смесь (\(pK_a\) уксусной кислоты 4,74)?
 Проще говоря, буферная система может противостоять изменениям рН. На это указывает индекс буфера термина (β).
Проще говоря, буферная система может противостоять изменениям рН. На это указывает индекс буфера термина (β). д. С другой стороны, буферная емкость офтальмологических и парентеральных препаратов должна быть достаточно низким, чтобы можно было быстро привести продукт к физиологическому pH при введении. Необходимо учитывать рН, химическую природу и объем вводимого раствора. Буферная емкость в диапазоне от 0,01 до 0,1 обычно достаточна для большинства фармацевтических растворов.
д. С другой стороны, буферная емкость офтальмологических и парентеральных препаратов должна быть достаточно низким, чтобы можно было быстро привести продукт к физиологическому pH при введении. Необходимо учитывать рН, химическую природу и объем вводимого раствора. Буферная емкость в диапазоне от 0,01 до 0,1 обычно достаточна для большинства фармацевтических растворов. Его повышают за счет увеличения концентрации компонентов буферной системы. Удвоение общей молярной концентрации буферной системы удвоит емкость буфера при данном рН. Буфер также можно увеличить, используя эквимолярные концентрации кислоты (ГК) и сопряженного с ней основания (А – ). Буфер имеет наибольшую емкость, когда отношение [соль]/[кислота] равно 1, т.е. [ГК] = [А – ]. Следовательно, уравнение буфера (1) может быть записано как
Его повышают за счет увеличения концентрации компонентов буферной системы. Удвоение общей молярной концентрации буферной системы удвоит емкость буфера при данном рН. Буфер также можно увеличить, используя эквимолярные концентрации кислоты (ГК) и сопряженного с ней основания (А – ). Буфер имеет наибольшую емкость, когда отношение [соль]/[кислота] равно 1, т.е. [ГК] = [А – ]. Следовательно, уравнение буфера (1) может быть записано как Но если мы продолжим добавлять HCl, слабое основание A — будут удалены. Как только A – истощается, любое добавление HCl будет отдавать свой протон воде, как показано в приведенной ниже реакции.
Но если мы продолжим добавлять HCl, слабое основание A — будут удалены. Как только A – истощается, любое добавление HCl будет отдавать свой протон воде, как показано в приведенной ниже реакции.
