Сабақ бойынша мұғалімнің жазбалары: (мұғалім және оқушы немен айналысады) І.Ұйымдастыру (5 минут)
1.2. Топқа бөлу (Оқушылар элементтердің жіктелуі бойынша металдар, бейметалдар, екідайлы элементтер деп 3 топқа бөлінеді) ІІ. Үй тапсырмасын сұрау (6 минут) 3 топқа тест сұрақтары таратылады. 1. Металдар периодтық жүйеде қалай орналасқан? Б) ІІ – ІІІ периодтың соңғы жағында В) тек қана І топтаорналасқан. 2. Тұрақты тотығу дәрежесін көрсететін металл? А) мыс Ә) магний Б) өттегі В) көмір. 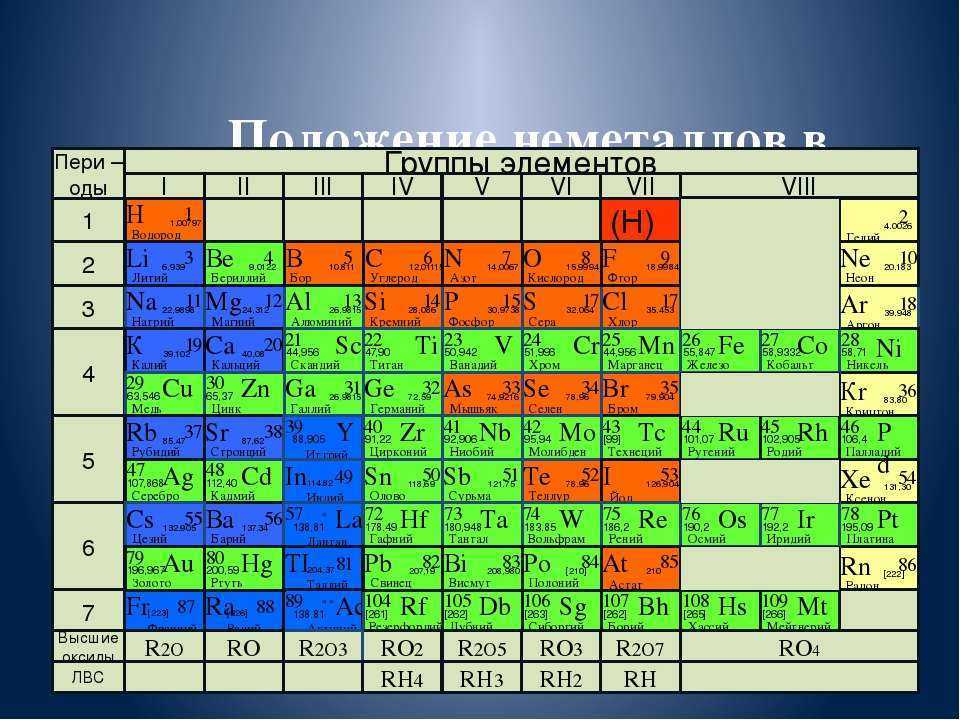 3. І топта орналасқан металл А) литий Ә) бром Б) сутегі В) гелий 4. Кіші период және үлкен периодтың жұп қатарында металдардың қаттылығы балқу температурасы, тығыздығы қалай өзгереді. А) кемиді Ә) алдымен кемиді, сосын артады Б) артады В) артады, сосын кемиді. 5. Мына элементтердің қайсылары металдарға жатады: Ne, P, Zn, As, Cl, Cu, Br, He. 6. Берілген элементтерді металдық қасиеттерінің өсу реті бойынша орналастырыңдар. 1. Na, Li, Cs, Pb, K 2. Al, Na, Mg, ІІІ. Жаңа сабақтың мағынасын ашу (2 минут)
ІҮ. «Бірге ойлаймыз» әдісі. 3 топқа тақырыпқа сай мәтін беріледі. Оқушылар берілген мәтінде тірек – сызба арқылы семантикалық талдау жасап, постер қорғайды. Сергіту сәті (2 мин) Бір бейметалдың реттік санын ойла, (мысалы: 6 –көміртек). Оны екіге көбейт (6*2=12), одан шыққан санға бесті қос (12+5=17), одан шыққан санды 5- ке көбейт (17*5=85). Енді сол шыққан санның соңғы санын алып таста (0), ал одан шыққан саннан 2- ні азайт (8-2=6). Сонда бастапқы ойлаған беметалдың реттік нөмері шығады. V. Жаңа сабақты қорытындылау (10 мин) «Миға шабуыл» 1. Мына заттардың арасынан бейметал және оның қосылыстарын ажырат: 2. Өзгерістерді жүзеге асыр: S→SO2→SO3→H2SO4→CaSO4 P→P2O5→H3PO4→K3PO4 С → СО → СО2 → Na2CO3 →NaCl ҮІ. Кері байланыс (не үйрендім, не қиын болды, сұрақ. ) (3 минут) Оқушылар себетке жабыстырады. ) (3 минут) Оқушылар себетке жабыстырады.– мен бүгінгі сабақты толығымен түсіндім – сабақты жартылай түсіндім, әліде ізденуім керек – бұл тақырып бойынша маған әлі де жүмыс жасау керек, дәрумендер керек Каталог: sabaq-kz -> attachment attachment -> Қазақ тілі мен әдебиет пәні мұғалімі Ибрагим Бегімхан Керімханұлы Қазақ әдебиеті, 9-сынып Тақырыбы: Қожа Ахмет Йасауи «Диуани хикмет» жүктеу/скачать 53. Достарыңызбен бөлісу: |
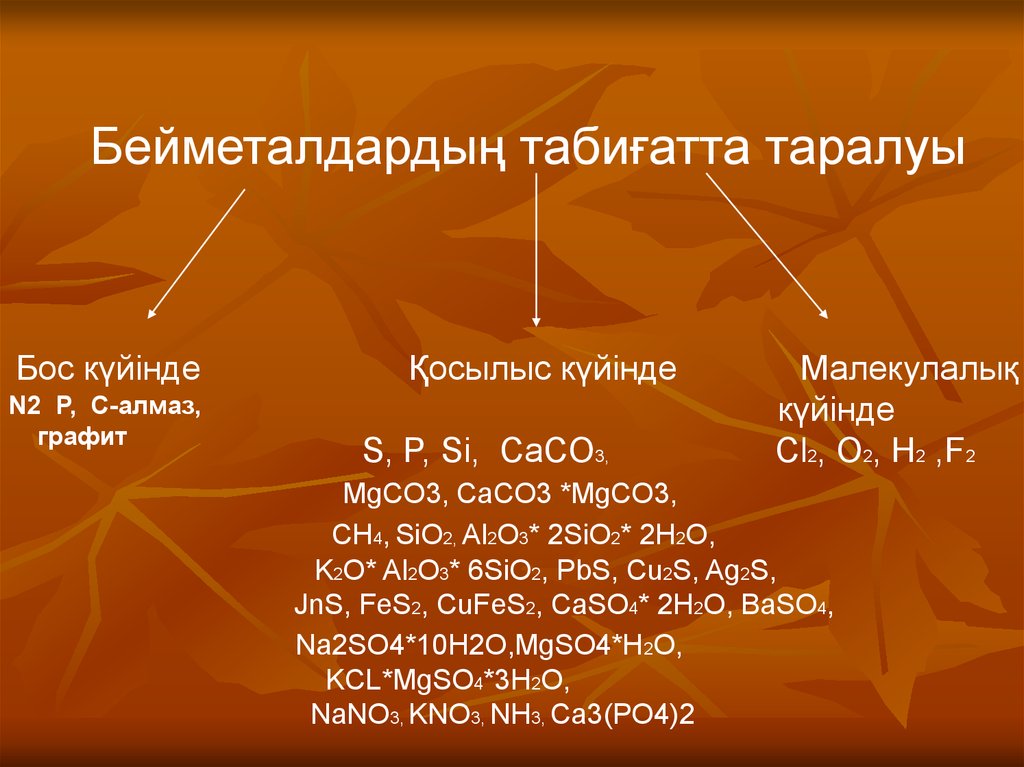
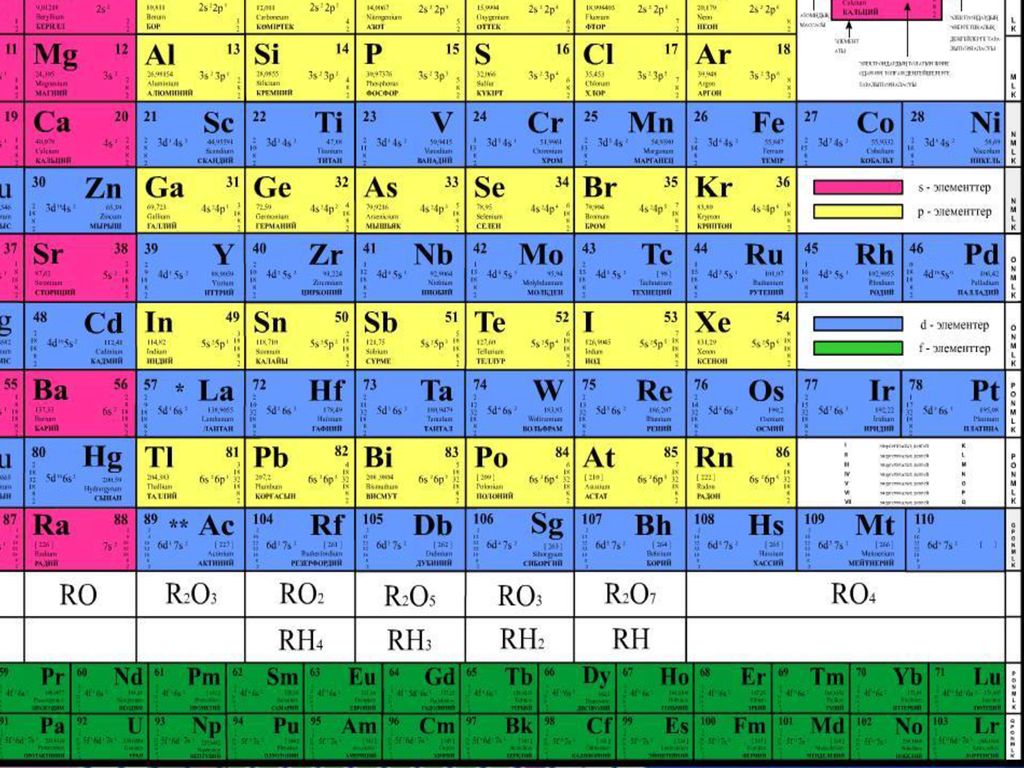
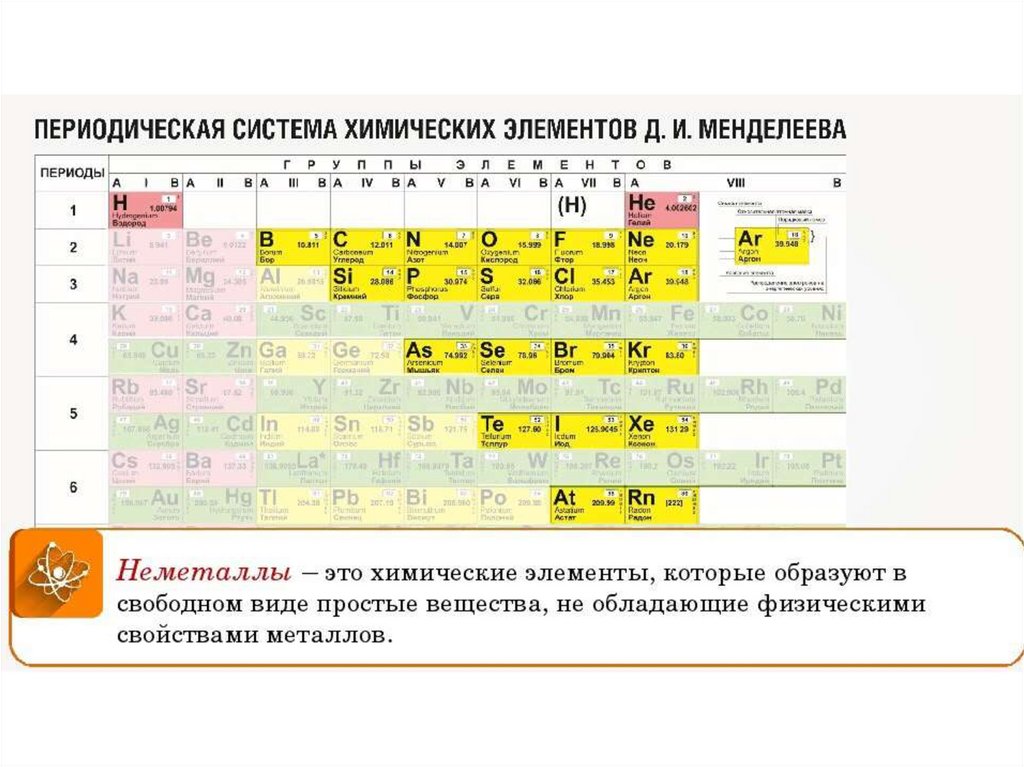
| Сабақтың тақырыбы: химиялық элементтердің периодтық жүйесіндегі бейметалдардың салыстырмалы сипаттамасы Сыныбы: 9 Сабақтың мақсаты: Білімділік: химияның негізгі түсініктері, бейметалдар құрылысы теориясы тұрғысынан Д.И. Менделеев жасаған химиялық элементтердің периодтық жүйесі және периодтық заңы, бейорганикалық заттардың кластары және олардың арасындағы генетикалық байланыс бойынша алған білімдерін тереңдету. Дамытушылық: химиялық формула, теңдеу құру дағдыларын, есеп шығару химиялық тәжірибе жасау біліктерін дамыту. Осының бәрін атом – молекулалық ілім тұрғысынан дәлелдеу. Тәрбиелік: оқушыларды ізденімпаздыққа, ұйымшылдыққа, өздігінен жауап беруге және оқушылар алдыңда сабақ айтқанда сенімділікпен, химиялық сөйлеуге жауап беруге тәрбиелеу. Бейметалдардың жалпы сипаттамасы Белгілі 110 элементтің 22-сі бейметалдарға жатады. Бейметалдардың тотықтырғыштық қасиеттері олардың периодтық жүйедегі орнымен анықталады. Периодта тотықтырғыштық қасиеттер солдан оңға қарай, ал топшаларда-жоғарыдан төмен қарай артады. Бұл периодта солдан оңға қарай электртерістіктің және электронтартқыштың артуына, ал негізгі топшаларда жоғарыдан төмен қарай бұл сипаттамалардың кемуіне байланысты. Элементтер-бейметалдар қалыпты жағдайда әртүрлі агрегаттық күйде болатын жай заттарды түзеді. He, Ne, Ar, Kr, Xe, Rn, H2, O2, N2-газдар, Br2-сұйық, ал қалғандары қатты заттар. Бейметалдар атомдары онша тығыз емес құрылым түзеді,онда атомдар арасында ковалентті байланыстар болады. Сутекпен және электртерістігі төмен бейметалдармен әрекеттескенде барлық бейметалдар тотықтырғыш қасиеттер көрсетеді. Сонымен қатар барлық бейметалдар (фтордан басқа) тотықсыздандырғыш қасиеттер де көресте алады. Бейметалдар оксидтері 2 топқа бөлінеді: тұз түзетін және тұз түзбейтін. Тұз түзбейтін оксидтерге N2O, NO, CO жатады. Бейметалдардың түзүші оксидтері қышқылдық оксидтер типіне жатады. SiO2-ден басқа барлық қышқылдық оксидтер суда ериді, нәтижесінде қышқылдар түзіледі. Бейметалдардың сутектік қосылыстарының суда ерігіштігі әртүрлі. Метан және силансуда нашар ериді. Аммиак және фосфин суда ерігенде әлсіз негіздер түзіледі. Табиғаттағы белгілі бейметалдар саны металдарға қарағанда аса көп емес.Периодтық жүйедегі бейметалдардың орнын анықтау үшін бор элементінен астатқа дейін көлденен сызық жүргізсе, кестенің жоғарғы оң жақ бұрышын ала негізгі топшаларда бейметалдардың орналасқаны байқалады. Периодта бейметалл элемент атомының ядро заряды біртіндеп өседі де, атом мөлшері кішірейеді. Сондықтан электрон қосып алуға бейімділігі жоғары және тотықтырғыштық қасиеті басым болады. Ал бейметалл орналасқан негізгі топшаларда (IV-VII) атомның радиусы неғұрлым кіші болса, ол ең сыртқы электрондарды күшті тартады. Демек, тотықтырғыштық қасиеті басым болады. Мысалы, фтор мен хлор атомын салыстырсақ, ең күшті тотықтырғыш-фтор. Бейметалдардың тотықтырғыш қабілеті электртерістіктің сан мәніне байланысты. Тотықтырғыш қасиеттердің өзгеруіндегі осы заңдылық сол бейметалдар түзетін жай заттарға да тән. Мысалы, фтор мен хлор атомдарының ең сыртқы қабатында бір-бірден жұптаспаған электрондар бар: +9F) 2e ) 7e 1s22s22p5; +17Cl )2e )8e )7e 1s22s22p63s23s23p5 Олар ортақ электрон жұбы арқылы ковалентті полюссіз байланыс түзуге қбілетті. Бос күйдегі фтор, хлор, бром, йодқа тән ортақ қасиет: екі атомды жай заттарының – F2, Cl2, Br2, I2 және одан басқа H2, O2, N2 газдарының кристалдық торлары-молекулалық . VI топтың негізгітопшасында оттек, күкірт, селен, теллур, полоний бар. Оттек электр терістігі жағынан фторға ғана орын береді. Оған -2 тотығу дәрежесі тән. Азот топшасындағы бейметалдардың сыртқы қабатында 5 электрон бар. Электр терістігі жағынан фтормен оттектен кейін тұрған азоттың тотығу дәрежесі -3, күшті тотықтырғыш қасиет көрсетеді. IV негізгі топшада тұрған көміртек пен кремний, III негізгі топшадағы бордың құрылыстары ұқсас және оларға кейбірортақ қасиеттер тән. Көміртек, кремнийдің кристалдық торы-атомдық. Жай заттардың химиялық қасиетін периодқа орналасуы бойынша оңнан солға қарай салыстырсақ бейметалдардың тотықтырғыштық қасиеті кемитінің байқауға болады. Мысалы, III период элементтерінің қасиеттері қалай өзгеретінің қарастырайық: Аргон-салғырт газ, химиялық реакцияға түспейді. Хлор-негізінен, тотықтырғыш қасиет көрсетеді. Күкіртте-тотықтырғыш және тотықсыздандырғыш қасиет бар. Фосфордың-күкіртке қарағанда тотықтырғыштық қасиеті әлсіз. Кремний, негізінен, тотықсыздандырғыш қасиетке ие. Демек, тотықтырғыш (бейметалда) қасиет азая келе тотықсыздандырғыш (металдарда) қасиет күшейеді. Бейметалл атомдарының сыртқы деңгеінде электрон саны 3-тен көп, негізіне, 4-8 электрон болады. Олар электрон қосып алуға бейім және тотықтырғыштық қасиет көрсетеді. Бейметалл элементтердің көбісі сутекті ұшқыш қосылыстарында теріс тотығу дәрежесін көрсетеді. Бейметалдар химиялық белсенді болғандықтан, табиғатта көбінесе қосылыс түрінде кездеседі. Осыған сәйкес оларды алу жолдары да алуан түрлі. Мысалы, фторидтер немесе хлоридтердің балқымасын электролиздеп бос күйіндегі фторды және хлорды алады. Бромды бромидтерден белсенді галогендермен орынбасу реакциясы арқылы алады. Йодты теңіз балдырларынан алады. Кейбір бейметалдар бос күйінде және қосылыс құрамында кездеседі. Азот пен оттек бос күйінде ауаның құрамында болады және ауаны сұйылту арқылы алады. Көміртек жай заттардың құрамында кездеседі.негізгі топшада орналасқан бейметалл элементтердің реттік нөмірі өскен сайын: а) ядро зарядының саны артады ә) атомның радиусы артады б)элементтердің электртерістігі кемиді, сондықтан тотықтырғыштық (е қосып алу) қабілеті азайып, тотықсыздандырғыш (е беру) қабілеті артады. IVA топша элементерінің жалпы сипаттамасы IVA топшаға p-элементтер: көміртек, кремний, германий, қалайы және қорғасын жатады. Олардың қозбаған атомдарының сыртқы деңгейінде төрт ns2np2 электроннан бар, оның ішінде p-электрондар жұптаспаған. Реттік нөмірдің өсуімен IV топша элемент атомдарының радиусы заңды түрде артады, иондану энергиясы және салыстырмалы электртерістігі кемиді. Топта жоғарыдан төмен қарай толтырылатын электрондық қабат санының және атом өлшемінің артуымен ішкі және сыртқы электрондардың ядроға тартылуы әлсірейді, сондықтан элементтердің бейметалдық қасиеттер топшада жоғарыдан төмен қарай әлсіреп, металдық қасиеттері артады. Сонымен қатар көміртек және кремний IVA топшаның басқа элементеріне қарағанда әртүрлі химиялық қосылыстар түзеді.Көміртек көптеген оттекті қосылыстарында +4 тотығу дәрежесін көрсетеді, тотығу дәрежесі +4- ке тең кремний қосылыстары да едәуір тұрақты.Бірақ германийден қорғасынға қарай +ң тотығу дәрежесін көрсететін қосылыстардың беріктігі төмендейді. Бұл топ элементтері үшін +2 тотығу дәрежесін көрсететін қосылыстар да тән. Кремнийдің мұндай қосылстарының беріктігі әлсіз, бірақ қорғасынға қарай артады. Д.И.Менделеев құрастырған химиялық элементтердің периодтық жүйесі VI тобының негізгі топшасында оттек, күкірт, селен, теллур және полоний бар. Ең соңғысы – радиоактивті металл. Элементтердің топтық атауы – халькогендер. 1.Күкірт атомының құрылысы. Химиялық элементтердің периодтық жүйесінде күкірт III периодта VI топтың негізгі топшасында орналасқан. Күкірт атомының ең сыртқы электрондық деңгейшесінде 6 валенттік электроны бар. Күкірт атомындағы электрондардың орналасуы: +16S) 2e )8e )6e Күкірт атомының электрондық формуласы: 1s22s22p63s23p4 Күкірт атомы электртерістігі аздау металдар мен сутектен 2 электрон 0осып алып, -2 тотығу дәрежесін көрсетеді. 2.Табиғатта кездесуі. Күкірт бірнеше мыңдаған жылдар бойы адам пайдаланып келе жатқан элементтің бірі. Күкірт тірі организмге қажет нәруыздың құрамына кіреді. Шаштағы каротинде. Құстардың қауырсынында және жануарлардың жүнінде күкірт көп болады. Құрамында күкірті бар кен орындары Қазақстанның Орталық, Оңтүстік және Шығыс аудандарында көптеп кездеседі. Одан басқа Италия, АҚШ, Орта Азия мен Қырымда бар. Атырау, Ақтау және Ақтөбе жерінде өндірілетін мұнай мен газдың құрамында күкіртті қосылыстар мол болады. 3.Физиологиялық әсері. Күкірт барлық тірі организмнің құрамында қосылыс түрінде болатын маңызы зор элемент. Бос күйдегі күкірт адам өмірі үшін аса қауіпті емес, дегенмен аз мөлшерінің іш жүргізетін әсері бар. Майда түйіршікті күкірт теріні тітіркендіреді. 4.Физикалық қасиеттері. Күкірттің бірнеші аллотропиялық түрөзгерісі бар. Олар кристалдық түрдегі-ромбты және моноклинді күкірт, аморфты және иілімді күкір деп аталады. Кәдімгі температурада ромбты күкірт тұрақты болғандықтан, табиғатта көбінесе осы түрі кездеседі. Ол иіссіз, суда ерімейтін сары түсті, морт сынатын кристал. Күкірт атомындағы жұптаспаған екі электрон есебінен күкірт атомы бір- бірімен байланысып, ашық тізбекті S2,S6 молекулаларын түзе алады. 5.Химиялық қасиеттері. Күкірт Химиялық реакция кезінде әрі тотықтырғыш, әрі тотықсыздандырғыш қасите көрсетеді.Күкірсутекті алу үшін қайнаған күкіртарқылы сутекті өткізеді, сол кезде күкіртсутекке тән шіріген жұмыртқаның иісіндей иіс шығады. 6.Табиғатта кездесуі. Күкіртсутек органикалық заттар шіріген жерлердің бәрінде пайда болады. Күкіртсутек табиғаттағы күкіртті арасан суларында, жаңартау атқылағанда түзілетін газдар құрамында кездеседі. 7.Күкіртсутекті алу. Лабораторияда күкіртсутекті темір (II) сульфидінің хлорсутек қышқылымен өндеу арқылы алады: FeS+2HCL=FeCL2+H2S Сульфидтердің көпшілігі суда ерімейді. Суда еритін сульфидтер-сілтілік металл тұздары: Na2S, K2S. Күкіртсутек қышқылы мен оның тұздарына қорғасын (II) нитраты анықтағыш реактив болады. Екі сынауыққа аздап күкіртсутек қышқылының H2S және натрий сульфидінің Na2S ерітіндісін қосып, үстіне 1-2 тамшы қорғасын (II) нитратын құйса, қорғасын (II) сульфидінің PbS қара түсті тұнбасы түзіледі. Қорғасын сульфиді суда да, күшті қышқылда да ерімейді. 8.Физиологиялық әсері. Күкіртсутек улы зат, адам онымен тыныс алса басы айналып, тұңшығады. Ұзақ демалса адам өміріне қауіпті. Күкіртсутек бар ауамен тыныс алғанда ол қанға сіңіп , темір ионымен тез байланысып қанның түсі қараяды. 9. Күкірт және оның қосылыстарының қолданылуы. Күкірт көп жерлерде қолданылады. Аңшы мылтығының оқ-дәрісін жасауда, көксағызды вулканизациялауға, резеңке, сіріңке, бояу өндірісінде, ауылшаруашылық зиянкестерімен күресуде қолданылады. Медицинада күкірт тері ауруларын емдеу үшін пайдаланылады. Өнеркәсіпте өндірілетін күкірттің жартысы күкірт қышқылын H2SO4 алуға жұмсалады. Күкіртсутектің емдік қасиеті де бар. Кейбір күкіртсутекті арасан сулармен ревматизм сырқатын емдейді. Сульфидтердің көпшілігі ашық түсті болуына байланысты түрлі түсті бояулар алу үшін қажет. Мысалы, сынап (II) сульфиді HgS ашық қызыл түс, кадмий сульфиді CdS ашық сары түс береді. Тері илеуге натрий сульфиді пайдаланылады. Көміртек тің тағы бір ерекшелігі ол алмаз түрінде диэлектрик болса, кремний, германий, қалайы нағыз типтік жартылай өткізгіштер болып табылады.Көміртек , кремний және германий сутекпен қосылыстарында ковалентті байланысқан атомдар тізбегін түзеді. Каталог: uploads -> doc -> 057e жүктеу/скачать 77.91 Kb. Достарыңызбен бөлісу: |
Бей Металл, Инк | Розничный переработчик в Чикаго, Индианаполисе, Мемфисе, Саванне и Ричфилде
Что отличает Bay Metal, Inc.
 ?
?Мы работаем с нашими клиентами на постоянной основе, стремясь максимизировать возврат клиентов.
Узнать больше о брокерской деятельности
Мы покупаем электродвигатели
AC, DC и дробные л.с.
У вас есть металлолом?
Купим алюминий, медь, латунь, бронзу, нержавеющую сталь и многое другое!
О нас
С 1969 года название Bay Metal, Inc. является синонимом качественного обслуживания клиентов.
Мы являемся лидером в области экологической безопасности.
Агрессивный управленческий и торговый персонал, вдохновленный руководителями с видением будущего, объединяется с опытными сотрудниками, чтобы поделиться сотнями лет практического опыта с энтузиазмом для решения новых задач. Bay Metal, Inc. постоянно адаптирует свои услуги для удовлетворения потребностей клиентов, никогда не упуская из виду высокую эффективность и постоянное совершенствование. В ответ на глобализацию вторичного сырья наши области сбыта расширились и теперь включают экспорт непосредственно потребителям в Индии, Китае и большей части Юго-Восточной Азии.
Что мы покупаем
Розничный лом
Медь – все формы и марки, алюминий – все формы и марки, латунь и бронза – все формы и марки, нержавеющая сталь л.с., трансформаторы – большие и малые – медь или алюминий, изолированный провод
Коммунальные счетчики
Наше стремление быть лидером в области экологической безопасности и осведомленности означает, что мы практикуем 100% переработку.
Переработка электроники
Компьютеры/ноутбуки, печатные платы, жесткие диски, сотовые телефоны
Список товаров, которые мы покупаем
|
|
Если вашего материала нет в списке, свяжитесь с нами.
Наш обученный персонал будет рад исследовать возможность вторичной переработки любых имеющихся у вас материалов.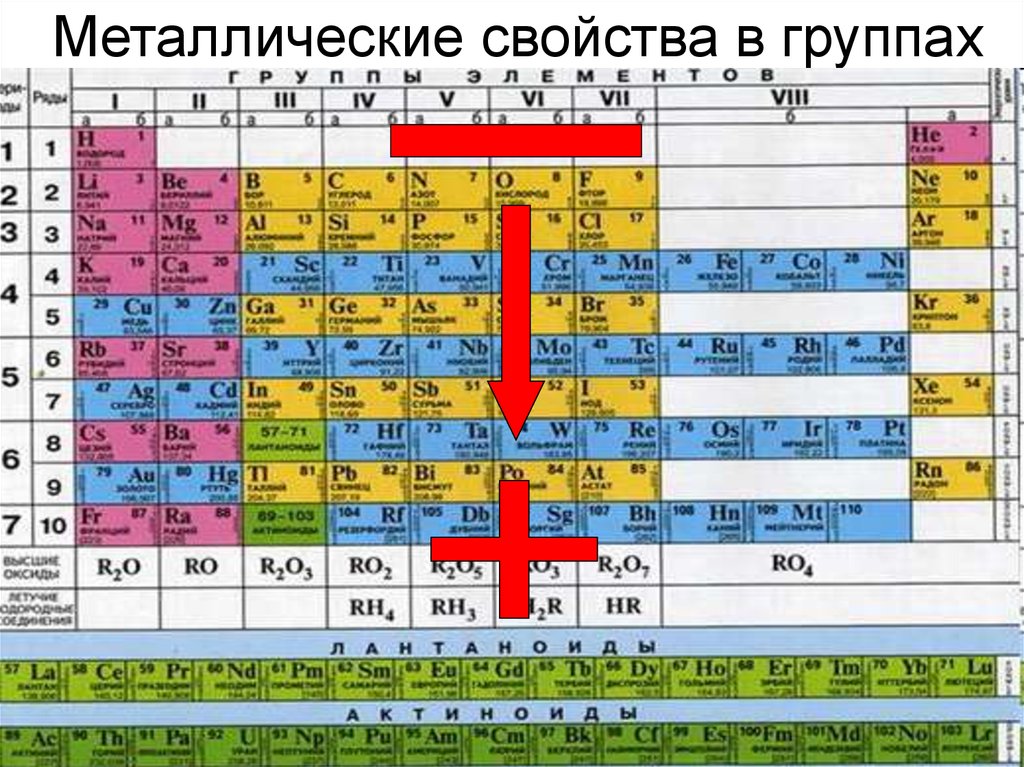
О компании | Бэй Металл, Инк
Группа Bay Metal занимается исключительно маркетингом и переработкой первичных и вторичных перерабатываемых металлов. Компании, входящие в эту группу, имеют более чем 50-летний опыт работы, а руководители имеют более 150-летний опыт работы в области переработки, маркетинга и плавки металлов. В сочетании с нашим отделом продаж это число достигает более 300 лет опыта.
С 1969 г., имя Bay Metal, Inc. было синонимом качественного обслуживания клиентов. Мы являемся лидером в области экологической осведомленности.
Агрессивный управленческий и торговый персонал, вдохновленный руководителями с видением будущего, объединяется с опытными сотрудниками, чтобы поделиться сотнями лет практического опыта с энтузиазмом для решения новых задач. Bay Metal, Inc. постоянно адаптирует свои услуги для удовлетворения потребностей клиентов, никогда не упуская из виду высокую эффективность и постоянное совершенствование. В ответ на глобализацию вторичного сырья наши области сбыта расширились и теперь включают экспорт напрямую потребителям в Китае, Индии и большей части Юго-Восточной Азии.
В ответ на глобализацию вторичного сырья наши области сбыта расширились и теперь включают экспорт напрямую потребителям в Китае, Индии и большей части Юго-Восточной Азии.
Что отличает Bay Metal, Inc. от других?
Мы работаем с нашими клиентами на постоянной основе, стремясь максимизировать возврат клиентов. Это достигается разными способами, в том числе:
- Помощь клиентам, желающим разработать процессы переработки на своих собственных предприятиях,
- Торговый персонал, который постоянно следит за внутренним и международным рынками металлов, помогая клиентам получать максимальную отдачу от своего материала,
- Металлургический анализ на месте, обеспечивающий точную идентификацию и определение характеристик металлов,
- Ряд специализированных систем, включая дробильные, калибровочные, разделительные и смесительные установки, в дополнение к стандартному металлообрабатывающему оборудованию,
- Поставка материала в нестандартной упаковке по спецификации потребителя, от первичного до вторичного металла – в кипах, кирпичах, слитках или порошке.

Что мы предлагаем
- Наш обширный, хорошо освещенный план этажа был разработан, чтобы способствовать организации, оптимизировать производственный процесс и максимизировать производительность
. - Объем закупленного однородного лома и устаревших материалов позволил Bay Metal считаться предпочтительным поставщиком для клиентов внутри страны и за рубежом.
- Bay Metal предлагает крытую площадку, обеспечивающую надежную защиту материала. Наши системы отгрузки и получения были специально разработаны для быстрого и эффективного перемещения продукции. Современный парк грузовиков
- Bay Metal предлагает широкий выбор транспортных средств для выполнения любой работы.
Охрана окружающей среды
Компания Bay Metal Group гордится своим экологическим подходом, начиная с зеленых насаждений в Ричфилде, штат Огайо. Обеспечение нулевого воздействия на окружающую среду для клиента является нашим главным приоритетом для владельца и руководства.



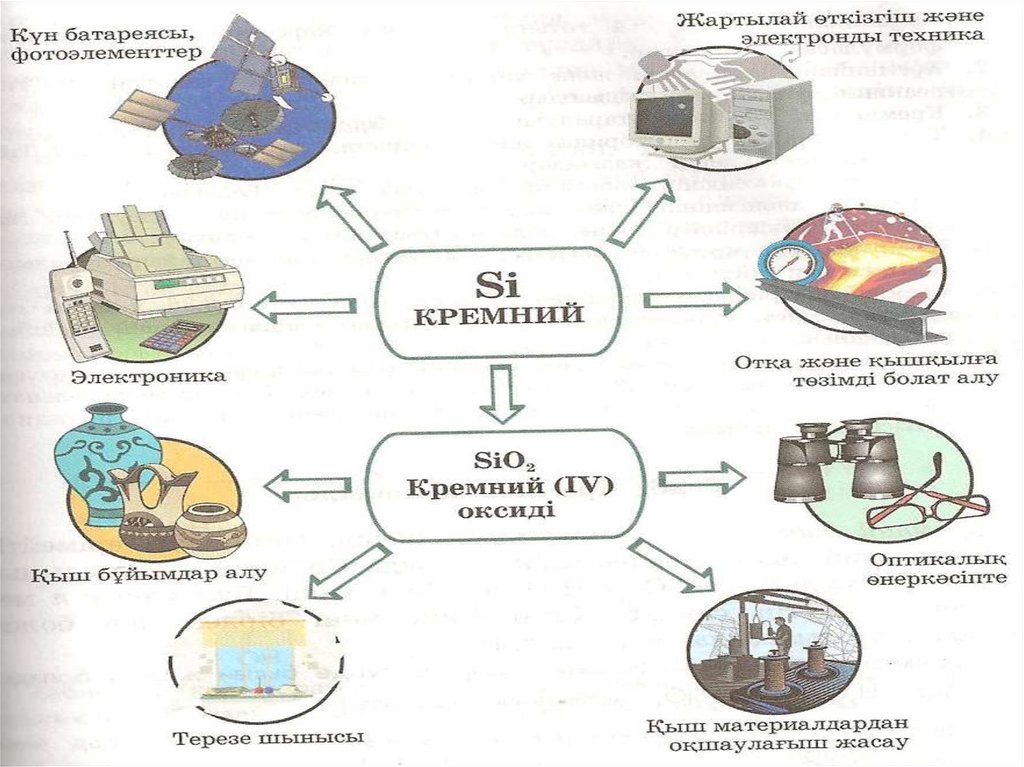
 45 Kb.
45 Kb.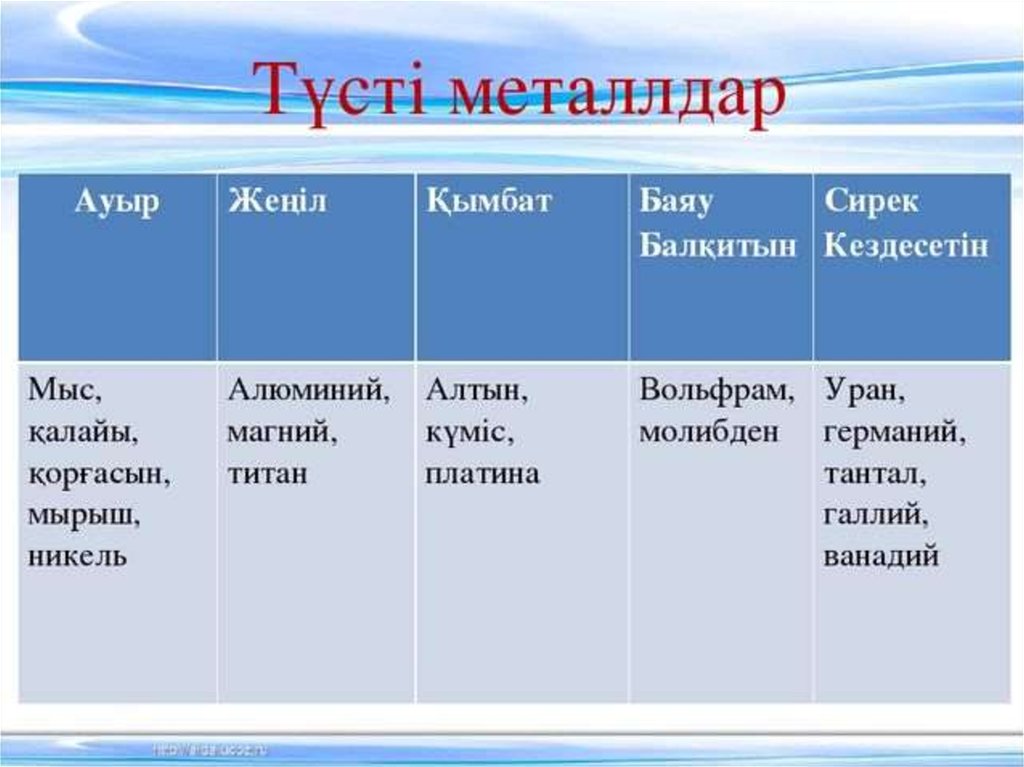 Бейметалдар топырақ массасының 84%-ін, өсімдік массасының 98,5%-ін және адам денесі массасының 97,5%-ін құрайды. Көміртек, сутек, азот, фосфор және күкірт органагенді элементтер болып табылады, өйткені олар нәруыз, май, көмірсулар және нуклеин қышқылдары молекулаларының құрамына кіреді. Біз демалатын ауа бейметалдардан түзілетін жай заттардың қоспасы болып табылады.
Бейметалдар топырақ массасының 84%-ін, өсімдік массасының 98,5%-ін және адам денесі массасының 97,5%-ін құрайды. Көміртек, сутек, азот, фосфор және күкірт органагенді элементтер болып табылады, өйткені олар нәруыз, май, көмірсулар және нуклеин қышқылдары молекулаларының құрамына кіреді. Біз демалатын ауа бейметалдардан түзілетін жай заттардың қоспасы болып табылады. Бейметалдардың кристалдық торында бос электрондар жоқ . Осыған байланысты бейметалдардың қатты заттары металдарға қарағанда жылуды және электр тоғын нашар өткізеді және оларға пластикалық қасиеттер тән емес.
Бейметалдардың кристалдық торында бос электрондар жоқ . Осыған байланысты бейметалдардың қатты заттары металдарға қарағанда жылуды және электр тоғын нашар өткізеді және оларға пластикалық қасиеттер тән емес.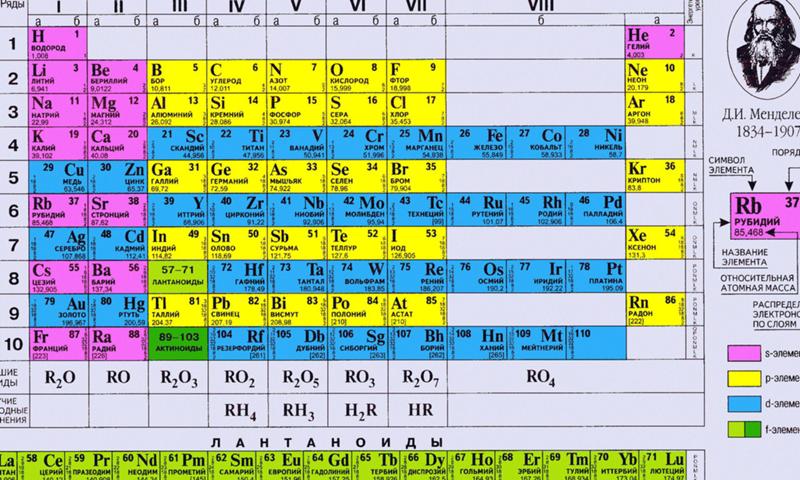


 Ол табиғатта бос күйінде және қосылыс түрінде де кездесді. Құрамында күкірті бар минералдың бірі- сульфидті минералдар: мысалы, қорғасын жылтыры PbS,мыс жылтыры Cu2S, күміс жылтыры Ag2S, мырыш алдамышы ZnS,пирит FeS2немесе темір колчеданы және халькопирит CuFeS2.
Ол табиғатта бос күйінде және қосылыс түрінде де кездесді. Құрамында күкірті бар минералдың бірі- сульфидті минералдар: мысалы, қорғасын жылтыры PbS,мыс жылтыры Cu2S, күміс жылтыры Ag2S, мырыш алдамышы ZnS,пирит FeS2немесе темір колчеданы және халькопирит CuFeS2. Осы қасиетіне сәйкес күкірт 0ос0ан денедегі жараны емдеуге пайдаланады.
Осы қасиетіне сәйкес күкірт 0ос0ан денедегі жараны емдеуге пайдаланады. Табиғи сульфидтер түсті және сирек кездесетін металл кендерінің негізін құрайды. Қазақстан жерінде ондай кен орындары көп кездеседі.
Табиғи сульфидтер түсті және сирек кездесетін металл кендерінің негізін құрайды. Қазақстан жерінде ондай кен орындары көп кездеседі. Адам күкіртсутекпен уланғанда тез арада таза ауамен демалдыру қажет.
Адам күкіртсутекпен уланғанда тез арада таза ауамен демалдыру қажет.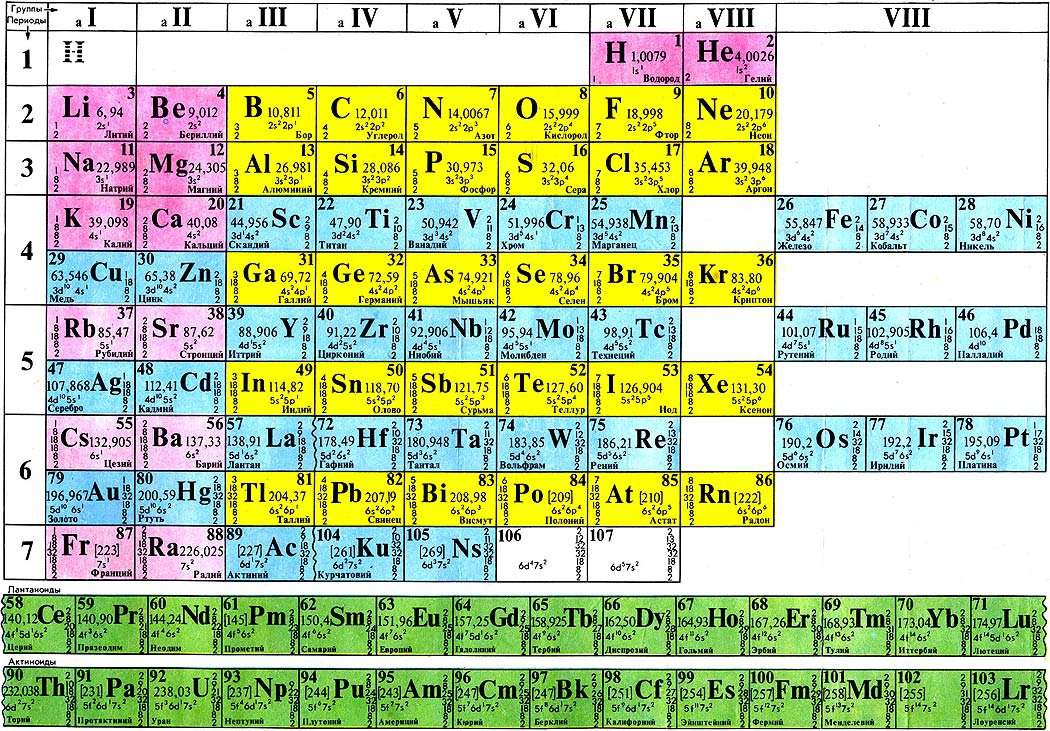 Бұл қасиет көміртектежақсы көрінеді. Кремний тікелей байланысқан максимум 6 атомнан ,ал германий тек і атомнан құралған тізбектерді түзеді. Қалайы мен қорғасынға бұл құбылыс мүлдем тән емес.
Бұл қасиет көміртектежақсы көрінеді. Кремний тікелей байланысқан максимум 6 атомнан ,ал германий тек і атомнан құралған тізбектерді түзеді. Қалайы мен қорғасынға бұл құбылыс мүлдем тән емес. с.
с.